
Необыкновенный мир
Строение молекул воды и их ассоциаты
"Мир чарующий и фантастический",- такими словами лауреат Нобелевской премии Альберт Сент-Дьердьи характеризует ощущения исследователя, изучающего структуру воды. Результаты тем сильнее впечатляют, что очень уж обычен сам объект изучения.
Итак, молекула воды (1H216О) состоит из двух атомов водорода (1Н) и одного атома кислорода (16O). И вот оказывается, что едва ли не все многообразие свойств воды и необычность их проявления определяется в конечном счете физической природой этих атомов, способом их объединения в молекулу и группировкой образовавшихся молекул.
В отдельно рассматриваемой молекуле воды атомы водорода и кислорода, точнее их ядра, расположены гак, что образуют как бы равнобедренный треугольник. В вершине его - сравнительно крупное кислородное ядро, в углах, прилегающих к основанию,- по одному ядру водорода.
Модель, предложенная датским физиком Нильсом Бором, показана на рисунке 4.
В соответствии с электронным строением атомов водорода и кислорода молекула воды располагает пятью электронными парами. Они образуют электронное облако. Облако неоднородно - в нем можно различить отдельные сгущения и разрежения. У кислородного ядра создается избыток электронной плотности. Внутренняя электронная пара кислорода равномерно обрамляет ядро: схематически она представлена окружностью с центром-ядром O2- (рис. 4, а). Четыре внешних электрона группируются в две электронные пары, тяготеющие к ядру, но частично не скомпенсированные. Схематически суммарные электронные орбитали этих пар показаны в виде эллипсов, вытянутых от общего центра-ядра О2-. Каждый из оставшихся двух электронов кислорода образует пару с одним электроном водорода. Эти пары также тяготеют к кислородному ядру. Поэтому водородные ядра - протоны - оказываются несколько оголенными, и здесь наблюдается недостаток электронной плотности.
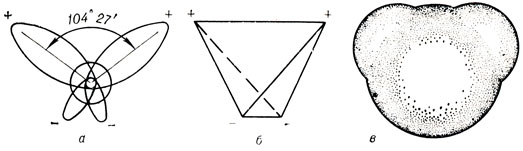
Рис. 4. Строение молекулы воды: а - угол между связами О-Н; б - расположение полюсов заряда; в - общий вид электронного облака молекулы воды
Таким образом, в молекуле воды различают четыре полюса зарядов: два отрицательных (избыток электронной плотности в области кислородного ядра) и два положительных (недостаток электронной плотности у двух водородных ядер). Для большей наглядности можно представить, что полюса занимают вершины слегка деформированного тетраэдра, центр которого - ядро кислорода (рис. 4, б).
Общий вид электронного облака молекулы воды показан на рисунке 4, в.
Почти шарообразная молекула воды имеет заметно выраженную полярность, так как электрические заряды в ней расположены асимметрично. Каждая молекула воды является миниатюрным диполем с высоким дипольным моментом - 1,87 дебая. Под воздействием диполей воды в 80 раз ослабевают межатомные или межмолекулярные силы на поверхности погруженного в нее вещества. Иначе говоря, вода имеет высокую диэлектрическую проницаемость, самую высокую из всех известных нам соединений.
Во многом благодаря этому, вода проявляет себя почти как универсальный растворитель. Ее растворяющему действию в той или иной мере подвластны и твердые гела, и жидкости, и газы.
Постоянно соприкасаясь со всевозможными веществами, вода фактически всегда представляет собой раствор различного, зачастую очень сложного состава.
Даже из свежевыпавшей дождевой воды можно выделить различные минеральные и органические вещества, растворенные в ней (до нескольких десятков миллиграммов на литр).
В природных пресных водах - речных, озерных - содержание растворенных веществ обычно не превышает 1 г/л. От нескольких единиц до десятков граммов на литр колеблется содержание солей в морской воде: например, в Балтийском море их не более 5 г/л, в Черном - 18, а в Красном море - около 40 г/л. В среднем в 1 л океанской воды растворено 34-35 г солей. Общее количество их настолько велико, что, выделенные из воды, они покрыли бы поверхность земного шара слоем стометровой толщины.
Солевой состав речных и морских вод различен не только количественно, но и качественно. На 89 % морские соли состоят из хлоридов (преимущественно - натрия и кальция), на 10 % - из сульфатов (натрия, калия и магния), на 1 % - из карбонатов (натрия и кальция), а также незначительных количеств других солей. В пресных водах набор минеральных примесей выглядит иначе. Больше всего здесь карбонатов (натрия и кальция) - до 80 %. Сульфатов (натрия, кальция и магния) - около 13 %. Остальные 7 % приходятся на хлориды (натрия и кальция) и другие соли.
Из газов в пресных и морских водах наиболее широко представлены кислород, азот, углекислый газ, сероводород. В чистых холодных истоках горных рек содержание кислорода может достигать 6 мг/л. В глубинных слоях Черного моря высока концентрация сероводорода - до 100 мг/л. Этот ядовитый газ присутствует и в нижних слоях некоторых озер.
В пресных и морских водах в небольших количествах имеются и разнообразные органические компоненты - растворимые соединения типа белков, Сахаров, спиртов, углеводородов и т. п. Это продукты жизнедеятельности и распада животных и растительных организмов, населяющих водоемы и их берега, а также отходы промышленности и сельского хозяйства.
Полярность молекул воды, наличие в них частично нескомпенсированных электрических зарядов порождает склонность к группировке молекул в укрупненные "сообщества" - ассоциаты. Оказывается, полностью соответствует формуле Н2О лишь вода, находящаяся в парообразном состоянии. Это показали результаты определения молекулярной массы водяного пара. В температурном интервале от 0 до 100 °С концентрация отдельных (мономерных молекул) жидкой воды не превышает 1 %. Все остальные молекулы воды объединены в ассоциаты различной степени сложности, и их состав описывается общей формулой (Н2О)х.
Непосредственной причиной образования ассоциатов являются водородные связи. Они возникают между ядрами водорода одних молекул и электронными "сгущениями" у ядер кислорода других молекул воды. Правда, эти связи в десятки раз слабее, чем "стандартные" внутримолекулярные химические связи, и достаточно обычных движений молекул, чтобы разрушить их. Но под влиянием тепловых колебаний так же легко возникают и новые связи этого типа. Возникновение и распад ассоциатов можно выразить схемой:
хH2O (H2O)x
(H2O)x
 (H2O)x
(H2O)xПоскольку электронные орбитали в каждой молекуле воды образуют тетраэдрическую структуру, водородные связи могут упорядочить расположение молекул воды в виде тетраэдрических координированных ассоциатов (рис. 5).
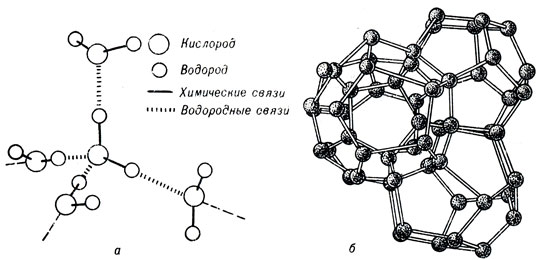
Рис. 5. Схема взаимодействия молекул воды (а) и одна из возможных моделей структуры льда (б)
Возможны и другие модели водной структуры, так как гетраэдрически связанные молекулы воды образуют своеобразные рои довольно стабильного состава. Пространства между роями заполняют мономерные молекулы воды.
Исследователи раскрывают все более тонкие и сложные механизмы "внутренней организации" водной массы. Кроме льдоподобной структуры, жидкой воды и мономерных молекул, описан и третий элемент структуры - негетра эдрической.
В последние годы появились данные о том, что определенная часть молекул воды ассоциирована не в трехмерные каркасы, а в линейные кольцевые объединения. Кольца, группируясь, образуют еще более сложные комплексы ассоциатов.
Изучение структуры жидкой воды еще не закончено; оно дает все новые факты, углубляя и усложняя наши представления об окружающем мире. Развитие этих представлений помогает нам понять многие аномальные свойства воды и особенности взаимодействия ее, как растворителя, с другими веществами.
|
ПОИСК:
|
© GEOMAN.RU, 2001-2021
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'