
Так ли проста вода
"Простейшее устойчивое соединение водорода с кислородом",- такое определение воды дает Краткая химическая энциклопедия. Все верно, только в химии простейшее - это еще далеко не простое.
До XIX века не знали даже, что вода - химическое соединение. Считали ее обычным химическим элементом. Лишь в 1805 году немецкий ученый Александр Гумбольдт и французский физик Жозеф Луи Гей-Люссак установили, что вода состоит из молекул, каждая из которых содержит два атома водорода и один кислорода.
И после этого свыше ста лет все и всюду считали, что вода - индивидуальное соединение, описываемое единственно возможной формулой Н2О.
Недостаточность этого положения выяснилась лишь в 1932 году. Мир облетела сенсация: кроме воды обычной, в природе существует еще и тяжелая вода. В молекулах такой воды место водорода занимает его тяжелый изотоп - дейтерий.
Тяжелую воду открыли американские физики Гаральд Юри и Эльберт Осборн. В 1933 году американский физико-химик Герберт Льюис совместно с Ричардом Макдо-нальдом впервые выделили ее в чистом виде.
В небольших количествах тяжелая вода постоянно и повсеместно присутствует в природных водах, внешне совершенно не отличаясь от обычной воды. Различить их можно лишь по физическим характеристикам. В молекулу тяжелой воды входят атомы не легкого водорода - протия (1Н), а его изотопа - дейтерия (2D), атом которого на единицу тяжелее протиевого, следовательно, молекулярный вес тяжелой воды на 2 единицы больше: 20, а не 18.
Формула тяжелой воды D2O. Эта вода на 10 % плотнее обычной, ее вязкость выше на 23 %. Кипит она при 101,42 °С, замерзает при +3,8 °С.
Такие особенности позволяют понять неравномерность содержания тяжелой воды в тех или иных природных водах. Например, в замкнутых водоемах ее больше, так как по сравнению с обычной водой она испаряется менее интенсивно. Поэтому тяжелой воды больше в местностях с жарким климатом. Обогащается дейтерием и поверхность океана на экваторе и в тропиках, тем более, что свою лепту вносят частые атмосферные осадки, при образовании которых идут процессы конденсации воды из паровой фазы (см. далее), а тяжелая вода конденсируется быстрее, чем легкая, следовательно, осадки обогащены тяжелой водой. Однако для океанской поверхности повышенное содержание тяжелой воды характерно лишь на низких широтах.
Вблизи полюсов свои особенности. В высоких южных широтах (в Антарктике) океанские воды заметно "легче". В этом сказывается влияние талых вод антарктических айсбергов, которые отличаются наиболее низким содержанием дейтерия на планете.
Невелика доля дейтерия и во льдах Гренландии, но тем не менее океанские воды высоких северных широт обогащены тяжелой водой. Тут сказывается таяние "тяжелых" арктических льдов.
Собственно тяжелая вода D2O в природе находится в ничтожных количествах - в миллионных долях процента. Преобладает ее разновидность, состав которой можна выразить формулой HDO.
Тяжелая вода - очень важное промышленное сырье, эффективный и относительно доступный замедлитель быстрых нейтронов. Поэтому уже сейчас ее широко применяют в различных реакторных установках. А в недалеком будущем тяжелая вода станет основным сырьем для термоядерной энергетики: 1 г дейтерия при термоядерном распаде дает в 10 млн. раз больше энергии, чем 1 г угля при сгорании. Очень обнадеживает практическая неисчерпаемость энергетического потенциала тяжелой воды - ведь в Мировом океане содержится 1015 тонн HDO.
Открытия последних лет показали, что тяжелая вода играет немалую роль в различных биологических процессах. Это и понятно, ведь она является постоянной и повсеместной примесью природных вод. Систематическое изучение ее воздействия на животных я растения начато сравнительно недавно. Различные исследователи независимо друг от друга установили, что тяжелая вода действует отрицательно на многие жизненные функции; это происходит даже при использовании обычной природной воды с повышенным содержанием тяжелой воды (рис. 2).
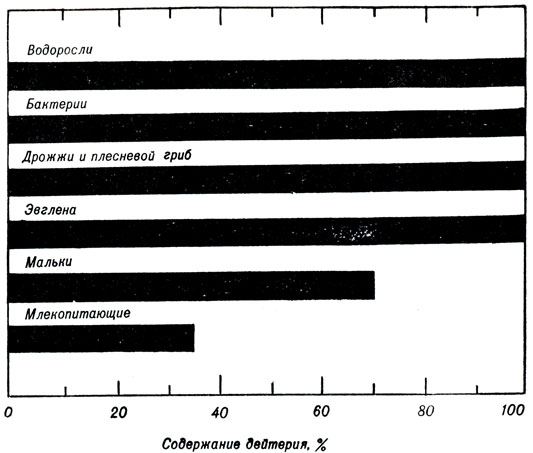
Рис. 2. Пределы выживаемости различных организмов в воде, содержащей дейтерий
Подопытных собак, крыс и мышей поили водой, 1/3 часть которой была заменена водой состава HDO. Через недолгое время начиналось расстройство обмена веществ животных, разрушались почки. При увеличении доли тяжелой воды животные погибали.
На развитие высших растений тяжелая вода также действует угнетающе; если их поливать водой, на половину состоящей из тяжелой, рост прекращается (рис. 3).
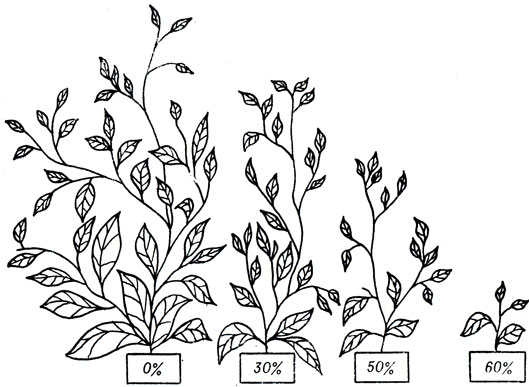
Рис. 3. Влияние различных концентраций дейтерия на рост растений
Пониженное содержание дейтерия в воде стимулирует жизненные процессы. Такие данные получили советские ученые Б. И. Родимов и И. П. Торопов. Они долгое время наблюдали за растениями и животными, потреблявшими воду, в которой содержалось дейтерия на 25 % ниже нормы. Оказалось, что, потребляя такую воду, свиньи, крысы и мыши дали потомство, гораздо многочисленнее и крупнее обычного, яйценоскость кур поднялась вдвое, пшеница созрела раньше и дала более высокий урожай.
Практически изучение тяжелой воды только начинается, но даже первые результаты показывают, сколько необычных свойств таит такое обыкновенное вещество, как вода.
Открытие тяжелой воды послужило толчком к выяснению фракционного состава воды. Вскоре была обнаружена сверхтяжелая вода Т2О. В ее составе место водорода занимает его природный изотоп, еще более тяжелый, чем дейтерий. Это тритий (Т), он радиоактивен, атомная масса его равна 3. Тритий зарождается в высоких слоях атмосферы, где идут природные ядерные реакции. Он является одним из продуктов бомбардировки атомов азота нейтронами космического излучения. Ежеминутно на каждый квадратный сантиметр земной поверхности падают 8-9 атомов трития.
В небольших количествах сверхтяжелая (тритиевая) вода попадает на Землю в составе осадков. Во всей гидросфере одновременно насчитывается лишь около 20 кг Т2О. Распределена тритиевая вода неравномерно: в материковых водоемах ее больше, чем в океанах; в полярных океанских водах ее больше, чем в экваториальных. По своим свойствам сверхтяжелая вода еще заметнее отличается от обычной: кипит при 104 °С, замерзает при +9 °С, имеет плотность 1,33.
Сверхтяжелую воду применяют в термоядерных реакциях. Она удобнее дейтериевой, так как чувствительнее в определении.
Перечень изотопов водорода не кончается тритием. Искусственно получены и более тяжелые изотопы 4Н и 5Н, тоже радиоактивные.
Таким образом, возможно существование молекул воды, в которых содержатся любые из пяти водородных изотопов в любом сочетании.
Но всем этим не исчерпывается сложность изотопного состава воды. Ведь существуют также изотопы кислорода. В периодической системе химических элементов Д. И. Менделеева значится всем известный кислород 16О. Существуют еще два природных изотопа кислорода - 17О и 18О. В природных водах в среднем на каждые 10 тысяч атомов изотопа 16О приходится 4 атома изотопа 17О и 20 атомов изотопа 18О.
По физическим свойствам тяжелокислородная вода меньше отличается от обычной, чем тяжеловодородная. Получают ее в основном перегонкой природной воды и используют как источник препаратов с меченым кислородом.
Помимо природных, существуют и шесть искусственно созданных изотопов кислорода. Как и искусственные изотопы водорода, они недолговечны и радиоактивны. Из них: 13О, 14О и 15О - легкие, 19О и 20О - тяжелые, а сверхтяжелый изотоп - 24О получен советскими физиками в 1970 году.
Существование пяти водородных и девяти кислородных изотопов говорит о том, что изотопных разновидностей воды может быть 135.
Наиболее распространены в природе 9 устойчивых разновидностей воды:
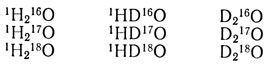
Основную массу природной воды - свыше 99 % - составляет протиевая вода - 1H216О. Тяжелокислородных вод намного меньше: 1H218O - десятые доли процента, 1Н217О - сотые доли от общего количества природных вод. Только миллионные доли процента составляет тяжелая вода D2O, зато в форме 1НDO тяжелой воды в природных водах содержится уже заметное количество.
Еще реже, чем D2O, встречаются и девять радиоактивных естественных видов воды, содержащих тритий:

Со всей научной строгостью классической водой следует считать протиевую воду 1H216О в чистом виде, то есть без малейших примесей остальных 134 изотопных разновидностей. И хотя содержание протиевой воды в природе значительно превосходит содержание всех остальных вместе взятых видов, чистой 1H216O в естественных условиях не существует. Во всем мире такую воду можно отыскать лишь в немногих специальных лабораториях. Ее получают очень сложным путем и хранят с величайшими предосторожностями. Для получения чистой 1H216О ведут очень тонкую, многостадийную очистку природных вод или синтезируют воду из исходных элементов 1H2 и 16О2, которые предварительно тщательно очищают от изотопных примесей. Такую воду применяют в экспериментах и процессах, требующих исключительной чистоты химических реактивов.
Формально протиевую воду можно было бы назвать легкой водой, но, как мы уже знаем, чистая 1H216О - редкость. Поэтому рабочим эталоном легкой воды считают смесь разновидностей воды состава 1H216О, 1H217О и 1H218О, взятых в том же соотношении, в котором присутствуют в воздухе соответствующие изотопы кислорода. Вот и получается, что, широко оперируя понятием "легкая вода", мы не можем представить ее однородной формулой.
Термин "тяжелая вода" на практике тоже не имеет формального эквивалента. Вода, отвечающая формуле D218O, которую как раз и следовало бы считать настоящей тяжелой водой, фактически заменяется смесью разновидностей воды с постоянной водородной частью (здесь это дейтерий) и с содержанием изотопов кислорода в соответствии с изотопным составом воздуха.
Вот какое непростое это "простейшее соединение" - вода. В дальнейшем, говоря о воде и называя ее общепринятую формулу Н2О, будем иметь в виду, что состав воды, даже полностью освобожденной от минеральных и органических примесей, сложен и многообразен.
|
ПОИСК:
|
© GEOMAN.RU, 2001-2021
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'