
Аномалии физических и химических свойств воды
В периодической системе элементов Д. И. Менделеева кислород образует отдельную подгруппу. Она так и называется: подгруппа кислорода.
Входящие в нее кислород, сера, селен и теллур имеют много общего в физических и химических свойствах. Общность свойств прослеживается, как правило, и для однотипных соединений, образованных членами подгруппы. Однако для воды характерно отклонение от правил.
Из самых легких соединений подгруппы кислорода (а ими являются гидриды) вода - легчайшее. Физические характеристики гидридов, как и других типов химических соединений, определяются положением в таблице элементов соответствующей подгруппы. Так, чем легче элемент подгруппы, тем выше летучесть его гидрида. Поэтому в подгруппе кислорода самой высокой должна быть летучесть воды - гидрида кислорода.
Это же свойство очень явственно проявляется и в способности воды "прилипать" ко многим предметам, то есть смачивать их. При изучении этого явления установили, что все вещества, которые легко смачиваются водой (глина, песок, стекло, бумага и др.), непременно имеют в своем составе атомы кислорода. Для объяснения природы смачивания этот факт оказался ключевым: энергетически неуравновешенные молекулы поверхностного слоя воды получают возможность образовывать дополнительные водородные связи с "посторонними" атомами кислорода.
Благодаря поверхностному натяжению и способности к смачиванию, вода может подниматься в узких вертикальных каналах на высоту гораздо большую чем та, которая допускается силой тяжести, то есть вода обладает свойством капиллярности.
Капиллярность играет важную роль во многих природных процессах, происходящих на Земле. Это благодаря ей вода смачивает толщу почвы, лежащую значительно выше зеркала грунтовых вод и доставляет корням растений растворы питательных веществ. Капиллярностью обусловлено движение крови и тканевых жидкостей в живых организмах.
Самыми высокими оказываются у воды как раз те характеристики, которые должны были бы быть самыми низкими: температуры кипения и замерзания, теплоты парообразования и плавления.
Температуры кипения и замерзания гидридов элементов кислородной подгруппы графически представлены на рисунке 6. У самого тяжелого из гидридов H2Те они отрицательны: выше 0 °С это соединение газообразно. По мере перехода к гидридам более легким (H2Se, H2S) температуры кипения и замерзания все более снижаются. Сохранись и далее эта закономерность, можно было бы ожидать, что вода должна кипеть при -70 °С и замерзать при -90 °С. В таком случае в земных условиях она никогда не могла бы существовать ни в твердом (лед), ни в жидком состояниях. Единственно возможным было бы газообразное (парообразное) состояние. Но на графике неожиданно резкий подъем - температура кипения воды +100 °С, замерзания -0 °С. Это наглядное преимущество ассоциативности - широкий температурный интервал существования, возможность осуществить все фазовые состояния в условиях нашей планеты. Ассоциативность воды сказывается и на очень высокой удельной теплоте ее парообразования. Чтобы испарить воду, уже нагретую до 100 °С, требуется вшестеро больше количества теплоты, чем для нагрева этой же массы воды на 80 °С (от 20 до 100° С).
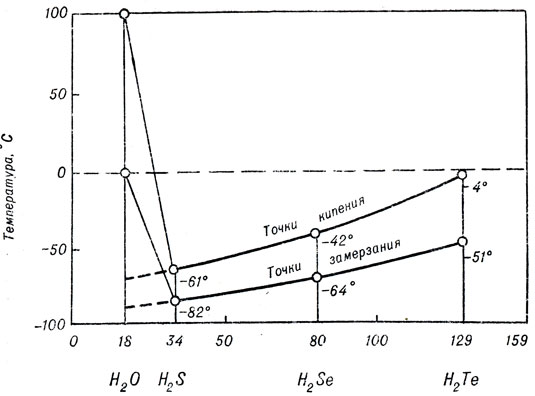
Рис. 6. Относительная молекулярная масса. Аномалии точек кипения и замерзания воды по сравнению с другими соединениями водорода, характеризующимися аналогичной молекулярной структурой
Каждую минуту миллион тонн воды гидросферы испаряется от солнечного нагрева. В результате в атмосферу постоянно поступает колоссальное количество теплоты, эквивалентное тому, которое бы вырабатывали 40 тысяч электростанций мощностью 1 млрд. киловатт каждая.
При плавлении льда тоже немало энергии уходит на преодоление ассоциативных связей ледяных кристаллов, хотя и вшестеро меньше, чем при испарении воды. Это и понятно - ведь молекулы H2О фактически остаются в той же среде, меняется лишь фазовое состояние воды.
Удельная теплота плавления льда более высокая, чем у многих веществ, она эквивалентна расходу количества теплоты при нагреве 1 г воды на 80 °С (от 20 до 100 °С).
При замерзании воды соответствующее количество теплоты поступает в окружающую среду, при таянии льда - поглощается. Поэтому ледяные массы, в отличие от масс парообразной воды, являются своего рода поглотителями тепла в cреде с плюсовой температурой.
Аномально высокие значения удельных теплоты парообразования воды и теплоты плавления льда используются человеком в
производственной деятельности. Знание природных особенностей этих физических характеристик иногда подсказывает смелые и эффективные технические решения. Так, воду широко применяют в производстве как удобный и доступный охладитель в самых разнообразных технологических процессах. После использования воду можно возвратить в природный водоем и заменить свежей порцией, а можно снова направить на производство, предварительно охладив в специальных устройствах - градирнях.
На многих металлургических производствах Донбасса в последнее время в качестве охладителя используют не холодную воду, а кипяток. Охлаждение идет за счет использования теплоты парообразования - эффективность процесса повышается в несколько раз, к тому же отпадает надобность в сооружении громоздких градирен. Конечно, кипяток-охладитель используют там, где нужно охладить объекты, нагретые выше 100 °С. А вот пример совсем из другой области человеческой деятельности - сельского хозяйства, садоводства. Когда поздней весной внезапные ночные заморозки угрожают цветущим плодовым деревьям, опытные садоводы находят выход, кажущийся совершенно неожиданным: они проводят дождевание сада. Пелена мельчайших водяных брызг окутывает замерзающие деревья. Капельки воды покрывают лепестки цветов. Превращаясь в лед, вода одевает цветы в ледяную шубу, отдавая при этом им свое тепло (335 Дж от 1 г замерзающей воды).
Широкое применение воды в качестве охладителя объясняется не только и не столько ее доступностью и дешевизной. Настоящую причину нужно тоже искать в ее физических особенностях. Оказывается, вода обладает еще одной замечательной способностью - высокой теплоемкостью. Поглощая огромное количество теплоты, сама вода существенно не нагревается. Удельная теплоемкость воды в пять раз выше, чем у песка, и почти в десять раз выше, чем у железа.
Способность воды накапливать большие запасы тепловой энергии позволяет сглаживать резкие температурные колебания на земной поверхности в различные времена года и в разное время суток. Благодаря этому вода является основным регулятором теплового режима нашей планеты.
Интересно, что теплоемкость воды аномальна не только по своему значению. Удельная теплоемкость разная при различных температурах, причем характер температурного изменения удельной теплоемкости весьма своеобразен: она снижается по мере увеличения температуры в интервале от 0 до 37 °С, а при дальнейшем увеличении температуры - возрастает. Минимальное значение удельной теплоемкости воды обнаружено при температуре 36,79 °С, а ведь это нормальная температура человеческого тела! Нормальная температура почти всех теплокровных живых организмов также находится вблизи этой точки.
Оказалось, что при этой температуре осуществляются и микрофазовые превращения в системе "жидкость - кристалл", то есть "вода - лед". Недавно было установлено, что при изменении температуры от 0 до 100 °С вода последовательно проходит пять таких превращений. Назвали их микрофазовыми, так как протяженность кристаллов микроскопична, не более 0,2-0,3 нм. Температурные границы переходов - 0,15, 30, 45, 60 и 100 °С.
Температурная область жизни теплокровных животных находится в границах третьей фазы (30-45 °С). Другие виды организмов приспособились к иным температурным интервалам. Например, рыбы, насекомые, почвенные бактерии размножаются при температурах, близких к середине второй фазы (23-25 °С), эффективная температура весеннего пробуждения семян приходится на середину первой фазы (5-10 °С).
Характерно, что явление прохождения удельной теплоемкости воды через минимум при температурном изменении обладает своеобразной симметрией: при отрицательных температурах также обнаружен минимум этой характеристики. Он приходится на -20 °С.
Если вода ниже 0 °С сохраняет незамерзшее состояние, например, будучи мелкодисперсной, то около -20 °С резко увеличивается ее теплоемкость. Это установили американские ученые, исследуя свойство водных эмульсий, образованных капельками воды диаметром около 5 микрон.
Углубленное изучение физического смысла и направлений практического применения данного явления еще ждут своих исследователей. Но уже и теперь ясно, что эти открытия представляют очень интересный и ценный познавательный материал.
|
ПОИСК:
|
© GEOMAN.RU, 2001-2021
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'