
Сколько в атмосфере атомного азота?
Вопрос о количестве атомов азота, как уже говорилось, весьма важен для всей проблемы окиси азота. Как обе проблемы решаются в совокупности на основе современной фотохимической теории, мы знаем. Всякая теория проверяется экспериментом. Современная схема процессов с участием N и NО дала разумное согласие с результатами измерений [NO] и [N(2D)]. А как с измерениями невозбужденных атомов N?
Оказывается, измерять концентрации N гораздо труднее, чем концентрации тех же атомов в возбужденном состоянии N(2D), хотя последние составляют лишь малую долю N. Причина тут проста: возбужденные атомы излучают запасенную ими энергию, переходя снова в атомы в основном состоянии. В случае N(2D) это будет зеленая линия с длиной волны 5200 Å. Именно ракетные измерения этой линии и дали упоминавшиеся нами данные о распределении [N(2D)] в атмосфере выше 140 км.

Измерение концентрации N
А обычные атомы азота? Оптическими методами определить их концентрацию очень трудно. Значит, остается основной метод изучения состава верхней атмосферы - масс-спектрометрический. Именно с ним, вернее, с полученными этим методом результатами и связаны сейчас основные проблемы атомного азота выше 100 км.
Масс-спектрометр регистрирует частицы в соответствии с их отношением массы к заряду. (В случае измерения ионного состава ионы поступают прямо из окружающей атмосферы, так сказать, в готовом виде. Когда исследуется нейтральный состав газа, включается специальный ионный источник, превращающий путем ионизации пучком электронов входящие нейтральные частицы в заряженные, которые и поступают в анализатор прибора.)
За условную единицу принято отношение массы к заряду у атома водорода, поэтому соответствующие массовые числа составляют 1 для Н, 2 для Н2, 14 для N, 16 для О, 28 для N2, 30 для NO, 32 для O2 и т. д.
С помощью масс-спектрометра в принципе можно проводить как абсолютные измерения (т. е. прямо получать количество, скажем, атомов О или молекул N2 в кубическом сантиметре), так и относительные. В последнем случае получают соотношение между концентрациями различных компонент, например тех же О и N2.
Обычно масс-спектрометр выполняет именно относительные измерения.
Все было бы хорошо и никаких трудностей с измерением концентраций N не возникало бы, если бы пик атомного азота на масс-спектрограммах образовывался... только из атомного азота. Выясняется, однако, что это не так. Как показали калибровки в лаборатории на спектрах контрольной смеси, в которой заведомо нет атомов N, а есть лишь N2, тем не менее наблюдается пик с массовым числом 14. Откуда он берется? Видимо, это побочный продукт воздействия электронов ионного источника. В самом приборе происходит разрушение части молекул N2 и образование атомов N, которые не имеют ничего общего с реальным существованием атомного азота в атмосфере.
Атомный азот
Лабораторные калибровки дали величины I14/I28 порядка 1 - 3%. Несколько паразитных частиц с М=14 на 100 молекул азота. А на полетных спектрах это отношение, как правило, оказывалось несколько выше (в среднем от 3 до 5 - 6%). Казалось бы, отнести разницу за счет атмосферных
атомов азота - и вот вам готовое отношение [N]/[N2] в атмосфере.
Однако у многих исследователей появились сомнения. Во-первых, несколько процентов от концентрации N2 - это довольно много для атомного азота, особенно в нижней части измерений, в области Е. Скажем, на высоте 130 км 1% от концентрации N2 составляет 1010 см-3. Это много больше, чем дают даже грубые теоретические модели распределения [N]. Во-вторых, отношение I14\I28 обнаружило сильные вариации от эксперимента к эксперименту, то поднимаясь до высоких значений, превосходящих 10%, то опускаясь до лабораторных величин. Как-либо разумно объяснить эти вариации, связать их с изменением состояния атмосферы, не удавалось.
И вот мнения специалистов по масс-спектрометрии разделились. Большинство предпочло воздержаться от анализа данных по I14\I28 и определения по ним количества атмосферного атомного азота.
Однако некоторые исследователи склонны приписывать полученную разницу между лабораторными и наблюдаемыми значениями I14\I28 целиком вкладу атмосферного атомного азота. Естественно, в этом случае получаются высокие [N]/[N2], порядка нескольких процентов, или, что то же (поскольку мы здесь можем считать концентрации N2 известными с хорошей точностью), высокие концентрации атомов азота, на 2, а то и на 3 порядка большие, чем дает современная фотохимическая теория. Можно ли подправить теорию, чтобы получить более близкие к эксперименту значения? Оказывается, нет. Существует принципиальная трудность, связанная реакцией (42). В этой реакции происходит одновременная гибель атомов N и молекул N0. Константа скорости реакции известна из лабораторных измерений и равна 2×10-11 см3×с-1. Помножив концентрацию N на концентрацию NO и на эту величину, мы, естественно, получим скорость гибели N и NО. В условиях равновесия эта скорость должна компенсироваться скоростями образования соответственно атомов N и молекул NО.
Взяв концентрации окиси азота, описанные выше, и концентрации N, измеренные в масс-спектрометрических экспериментах, мы получим очень высокие скорости гибели N и NO. Так, на высотах 150 - 160 км величина [N][NO]α2 будет составлять 104 - 105 см-3×с-1. Это очень много. Никакие известные механизмы (включая и реакцию с возбужденным азотом N (2D)) не способны обеспечить столь высокую скорость образования окиси азота на этой высоте. Аналогичная картина наблюдается и на других высотах, где значения [N] высоки. Чтобы показать, что полученные высокие значения [N][NO]α2 невозможно принять с точки зрения скорости образования N, нам необходимо подробнее рассмотреть вопрос, откуда берется атомный азот.
Действительно, мы рассматривали присутствие в верхней атмосфере атомов азота как нечто заданное свыше, как нечто само собой разумеющееся. Теперь настало время подумать о том, как, в результате каких процессов, появляются в атмосфере атомы N.
Мы знаем, что в атмосфере начиная с некоторых высот активно идет диссоциация молекулярного кислорода. В результате этого процесса, вызываемого солнечным ультрафиолетовым излучением, молекулы O2 распадаются на два составляющих их атома О. Процесс этот идет настолько эффективно, что уже на высотах 130- 140 км концентрации О и O2 сравниваются, а выше кислород в атмосфере присутствует в основном в виде атомов.
Так может, подобное же происходит и с азотом? Может, зарегистрированные масс-спектрометрами относительно высокие концентрации N есть лишь отражение эффективно идущей диссоциации N2?

Диссоциация N2
Оказывается, нет. Молекулу N2 мы не раз называли "ленивой" за ее нежелание вступать в различного рода реакции. Не изменила она себе и в этом случае. Молекулярный азот активно не хочет подвергаться диссоциации солнечным излучением. В этом отношении он полностью игнорирует пример своего коллеги молекулярного кислорода. Если для O2 коэффициент диссоциации составляет около 10-5 с-1 (вероятность диссоциации под действием солнечного излучения в расчете на одну молекулу), то для N2 эта величина равна всего лишь 10-12 с-1. Разница, как видите, весьма внушительная - в миллион раз.
Простой расчет показывает, что если бы в атмосфере действовала только диссоциация N2 солнечным излучением (так называемая фотодиссоциация), то концентрации атомов азота в верхней атмосфере были бы ничтожно, неизмеримо малы.
На самом деле на помощь фотодиссоциации приходит диссоциация N2 в результате цикла ионных реакций. Действительно, посмотрите на эти реакции, о которых мы говорили в главе 4:
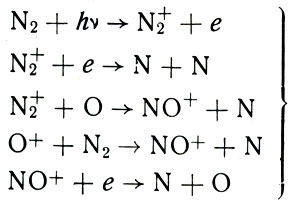
Формула 47
Здесь в левой части в качестве исходных материалов стоит N2 или полученные из него ионы N2+ и NO+. А в правой части в качестве получаемых продуктов - атомы N. Таким образом, ионизационно-рекомбинационный цикл процессов выше 100 км непрерывно и неуклонно ведет к важному побочному результату - перемалыванию молекул N2 в атомы N. Так, молекула N2, которая, как мы видели, успешно сопротивляется фотодиссоциации, не в силах устоять перед более мощным механизмом диссоциации в ионных реакциях.
Итак, механизм диссоциации N2 нам теперь известен. Можем ли мы, не вдаваясь в детали, оценить скорость диссоциации N2, а значит, и скорость образования N? Оказывается, можем. Выше некоторого уровня основными ионами, образующимися в процессе ионизации, являются ионы N2+ и О+. Но именно эти ионы в ходе описанных выше реакций и приведут к преобразованию N2 в N. Значит, практически почти каждый акт ионизации ведет к разрушению одной молекулы азота N2 и к образованию взамен двух атомов N. И мы можем в первом приближении положить, что скорость образования N равна удвоенной общей скорости ионизации g. На самом деле (за счет добавки ионов О2+, которые не приводят к диссоциации N2) эта скорость несколько меньше, чем 2g, и уж, конечно, никогда не может быть больше.
Скорости ионизации нам известны достаточно хорошо. Мы можем положить, что на выбранной нами высоте величина 2g заведомо не превышает 4×103 см-3×с-1. Сравнивая это значение с полученной выше величиной [N][NO]α2 = 104÷105 см-3-с-1, мы приходим к неутешительному выводу, что и с точки зрения скорости образования атомов N последняя величина слишком (на порядок!) высока. Общепринятого решения проблемы [N] пока не существует. Автор считает, что правильны принятые концентрации окиси азота и необходимо отказаться от высоких, значений [N], получаемых в ряде масс-спектрометрических измерений.
В пользу этого говорит еще и то, что в последнее время появились (пока качественные) идеи объяснения высоких значений I14/I28 в масс-спектрометрических экспериментах. Как мы помним, в лаборатории при калибровке измеряют отношение I14/I28, с которым сравнивают потом измерения в атмосфере.
А что - возникает вопрос - если молекулы атмосферного азота легче распадаются в масс-спектрометре N и N+, чем молекулы лабораторного газа, потому что первые находятся в возбужденном состоянии, а вторые - нет? Ведь мы еще очень мало знаем о состоянии возбуждения атмосферного газа. И вполне можем предположить, что (по крайней мере в случае N2) процент возбужденных частиц достаточно велик. А возбужденные частицы в силу запасенной в них внутренней энергии должны быть более "податливы" к разрушению под внешним воздействием (в нашем случае - под действием электронов ионного источника), чем невозбужденные. Не в этом ли разгадка проблемы высоких I14/I28?
Это пока всего лишь идея, не нашедшая количественного решения. Однако она тем более завлекательна, что в случае удачи мешающие всем высокие значения I14/I28 могут стать отличным индикатором состояния возбуждения одной из важнейших компонент верхней атмосферы - молекулярного азота.
|
ПОИСК:
|
© GEOMAN.RU, 2001-2021
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'