
Что во что переходит или окончательная схема процессов
Мы рассмотрели все этапы той карусели заряженных частиц, которая непрерывно идет в верхней атмосфере и называется ионизационно-рекомбинационным циклом процессов. Соединим теперь отдельные части и посмотрим на картину преобразования ионов и электронов в целом. Помним только, что речь идет о дневной ионосфере на высотах 100 - 200 км, где нет ни отрицательных ионов, ни ионов-связок, которые так усложняют жизнь в области D, и где можно не беспокоиться о динамических процессах. Итак, в результате фотоионизации образуются положительные ионы и электроны. Электроны, как говорится, все на одно лицо - их различить невозможно. А вот ионы образуются разные. В различных количествах. И их дальнейшая судьба складывается по-разному.
Атмосфера на высотах 100 - 200 км, как мы знаем, состоит из молекул и атомов азота и кислорода. Значит, именно ионы N2+, О2+, О+ и N+ образуются в результате фотоионизации. О+ и N+ - ионы атомные. Для них нет быстрой реакции рекомбинации с электроном. Значит, их судьба ясна - они рано или поздно гибнут в ионно-молекулярных реакциях, образуя другие ионы. Какие именно? И это ясно - ионы с меньшим потенциалом ионизации, т. е. О2+ и NO+. А вот у образующихся молекулярных ионов N2+ и О2+ судьба сложнее. Два типа процессов борются за их уничтожение: диссоциативная рекомбинация и ионно-молекулярные реакции. Исход этой борьбы различен для O2+ и N2+. Ионы молекулярного кислорода гибнут в основном в реакциях рекомбинации с электронами, и только на высотах, где много молекул окиси азота (область Е и несколько выше), на судьбу этих ионов начинает влиять реакция О2+ с NO. А вот на концентрацию ионов N2+ диссоциативная рекомбинация совсем не влияет. Слишком велика активность этих ионов в ионно-молекулярных реакциях - эти реакции целиком и определяют гибель N2+. Если выразить все в терминах "времени жизни", то это будет выглядеть так: время жизни N+ относительно ионно-молекулярных реакций много меньше, чем время жизни N2+ относительно диссоциативной рекомбинации.

Диссоциативной рекомбинации
Эффективность гибели N2+ в ионно-молекулярных реакциях (на рисунке обозначена И-М) настолько высока, что равновесные концентрации этих ионов в ионосфере оказываются очень низкими. Скажем, ниже 150 км концентрации N2+, как правило, меньше предела чувствительности масс-спектрометра. И это несмотря на то, что образуется ионов N2+ в процессе фотоионизации на таких высотах больше, чем каких-либо других ионов, поскольку молекулы азота являются там доминирующей компонентой нейтральной атмосферы. Это явление в аэрономической литературе иногда называют "ненаблюдаемой ионизацией". Иначе говоря, в данном случае ионизация как процесс идет очень активно, но из-за быстрых процессов гибели результирующая равновесная концентрация мала и сплошь и рядом ненаблюдаема.
Последним типом положительных ионов, о судьбе которых мы еще ничего не сказали, являются ионы NO+. Эти ионы образуются в результате ионно-молекулярных реакций. Прямая ионизация молекул NО, конечно, идет, но на рассматриваемых сейчас высотах очень мало может добавить (из-за малости [NO] по сравнению с основными нейтральными компонентами) к активному образованию N0+ в ионных реакциях. Сами же ионы NО+ начать новую ионно-молекулярную реакцию и превратиться в другой ион не могут: у них слишком низкий потенциал ионизации. А следовательно, их дальнейшая судьба ясна - они гибнут только в реакциях диссоциативной рекомбинации.
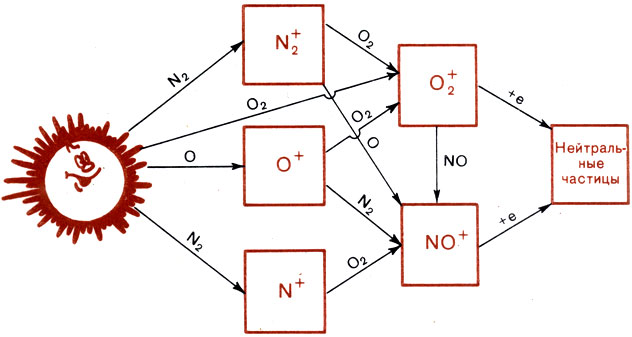
Все, о чем мы говорили здесь, можно очень компактно изобразить на схеме. Такая схема показана на рисунке. Квадратики обозначают равновесные концентрации ионов и электронов, а стрелки соответствуют фотохимическим реакциям. Символы возле стрелок показывают, какая частица участвует в данной реакции. Скажем, N2 возле стрелки, соединяющей О+ и NО+, означает, что идет реакция ионов О+ с молекулами N2, образующая N0+. Легко видеть, что это упоминавшаяся уже реакция (16).
Итак, глядя на схему, мы можем теперь подвести итог сказанному. Цикл преобразований положительных ионов начинается с ионизации (в нашем случае - с фотоионизации), в результате' которой образуются первичные ионы N2+, О+, O2±, N+. Ионно-молекулярные реакции перераспределяют ионы, превращая в конце концов N2+, О+ и N+ в О2+ и NО+. Эти два иона и участвуют в последней фазе цикла - рекомбинации ионов с электронами, приводящей к исчезновению заряженных частиц.
Схемы, подобные приведенной, очень распространены в аэрономий и очень удобны. Кроме общего описания процесса в целом, как это мы сделали выше, они позволяют получать и уравнения для равновесных концентраций любого иона. Для этого надо в левую часть уравнения записать все процессы, стрелки которых упираются в данный квадрат, а в правую - процессы, стрелки которых от него начинаются. Скажем, в случае NО+ (следите по схеме!)
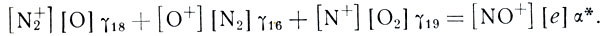
Формула 20
Вот и уравнение баланса для ионов NО+. Просто, не правда ли?
Нейтральные частицы
|
ПОИСК:
|
© GEOMAN.RU, 2001-2021
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'