
Замерзание воды
Если "абсолютно чистую" воду налить в "абсолютно чистый" сосуд и охладить их до "точки замерзания", т. е. до 0°С, то вода не замерзнет. Более того, если продолжать понижать температуру, то вода может не замерзнуть и при -10° С и даже при -32° С. Правда, опыт, подобный описанному, никогда не был осуществлен. Никто не представляет себе, где взять "абсолютно чистую" воду или "абсолютно чистую" посуду. Новейшие лабораторные методы позволяют получить очень чистую воду и очень чистую стеклянную посуду, но нет никакой уверенности, что все примеси полностью удалены.
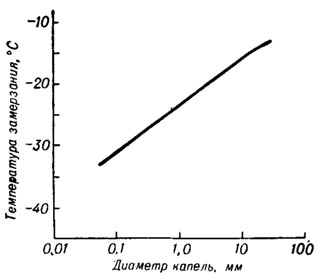
Рис. 12. График приближенной зависимости температуры замерзания чистой воды от размера капель (по Биггу)
С помощью самой стерильной аппаратуры удалось установить, что воду можно переохладить до температур значительно ниже 0°С. Величина переохлаждения зависит от количества воды: чем меньше воды, тем ниже температура, при которой наступает замерзание. Рисунок 12 показывает зависимость средней температуры замерзания от размера водяных капель. Опыты многих ученых во всем мире, в особенности Дорча и Хэккера (США) и Бигга (Австралия), дали следующую картину. Когда температура понижается примерно до -39° С, то те капельки, которые еще не замерзли, быстро превращаются в лед. В. Шефер из лаборатории "Дженерал электрик" (Нью-Йорк) первым обнаружил в 1946 г., что даже мельчайшие водяные капли замерзают при этой температуре.
Есть основания считать, что к постепенному понижению температуры замерзания с уменьшением диаметра капли и к внезапному замерзанию капелек при температуре примерно -39° С приводят различные причины.
Было высказано предположение, что, чем больше объем воды, тем больше вероятность присутствия в ней особого типа частиц, на которых лед начинает расти уже при умеренном переохлаждении. Такие частицы называются ядрами кристаллизации.
При отсутствии таких ядер лед может возникать только путем случайной группировки большого числа молекул воды в агрегаты, напоминающие лед. Б. Дж. Мэйсон, выдающийся английский специалист по физике облаков, был одним из первых исследователей, кто подробно изучил это явление.
Выясним, как идет процесс замерзания "чистой" воды.
Водяной пар состоит из отдельных молекул, расположенных далеко друг от друга и не связанных между собой; другими словами, молекулы пара могут двигаться, . не оказывая влияния друг на друга. Когда молекулы водяного пара объединяются, образуя жидкость, т. е. воду, они становятся более связанными друг с другом. Молекулы могут свободно перемещаться, например, когда сосуд с жидкостью наклоняется. Когда вода замерзает, молекулы ее жестко связываются в конфигурацию, определяемую структурой молекул. Атомы водорода и кислорода, которые составляют молекулу воды Н20, выстраиваются в плотную, упорядоченную структуру.
Переход из жидкого состояния в твердое сопровождается понижением температуры вещества. По мере того как вода становится холоднее, отдельные молекулы ее движутся медленнее и для атомов водорода и кислорода увеличивается вероятность занять то положение, которое соответствует жесткой правильной структуре. Когда заметное количество молекул занимает подобное положение, они действуют как ядро, к которому присоединяются другие молекулы, и вода начинает замерзать. Чем ниже температура, тем больше вероятность образования ядер такого типа.
Расчеты показывают, что вероятность быстро увеличивается, когда температура падает ниже -39° С. Вот почему невозможно переохладить чистую воду ниже этой температуры. При более высокой температуре образование льда обычно вызывается твердыми частицами, на которых молекулы воды могут принимать нужное положение.
|
ПОИСК:
|
© GEOMAN.RU, 2001-2021
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'