
Подкласс Г. Силикаты с непрерывными слоями тетраэдров Si04 в кристаллических структурах
![Рис. 324 Гексагональная сетка связанных групп SiO><sub>4</sub>, образующих непрерывный слой (А) в проекции вдоль оси с. Внизу (Б) показан вид сбоку (вдоль оси а) решетки, состоящей из двух слоев групп SiO<sub>4</sub> и заключенного между ними одного слоя Mg[OH]<sub>2</sub>. Характерно, что вершинки тетраэдров SiO<sub>4 </sub>в обоих слоях обращены навстречу друг другу](pic/000336.jpg)
Рис. 324 Гексагональная сетка связанных групп SiO4, образующих непрерывный слой (А) в проекции вдоль оси с. Внизу (Б) показан вид сбоку (вдоль оси а) решетки, состоящей из двух слоев групп SiO4 и заключенного между ними одного слоя Mg[OH]2. Характерно, что вершинки тетраэдров SiO4 в обоих слоях обращены навстречу друг другу
Здесь мы рассмотрим слюдоподобные силикаты, характеризующиеся слоистыми кристаллическими решетками гексагонального или псевдогексагонального строения (рис. 324.)
Характерной химической особенностью слюдоподобных минералов является то, что в их составе, так же как и в группе амфиболов, всегда принимает участие гидроксил ОН, нередко вместе с F. Из катионов, которые вместе с гидроксильными группами непосредственно связаны со слоями кремнекислородных тетра-эдров,обычно распространены Mg2+ и Аl3+, а в качестве их заместителей- Fe2+, Ni2+, (Mn2+), Li1+ и, соответственно, Fe3+, реже Cr3+, V3+. Кроме того, во многие минералы, в структуре которых тетраэдры SiO4 частично заменены АlO4, входят дополнительные крупные катионы: К1+, Na1+, Са2+, а также молекулы воды (все они, как будет показано ниже, в виде связующих элементов располагаются между слоистыми пакетами, составленными кремнекислородными слоями и ионами, непосредственно с ними связанными).
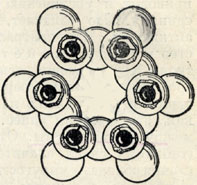
Рис. 325. Гексагональное кольцо тетраэдров SiO4 в плане. Вершинки тетраэдров с активными кислородными ионами обращены к наблюдателю. Черные шарики - ионы Si4+ (в окружении четырех ионов кислорода)
Физические свойства слюдообразных минералов, естественно, находятся в теснейшей зависимости от особенностей кристаллической структуры. Строение плоских сеток прежде всего сказывается на облике кристаллов, обладающих симметрией, очень близкой к гексагональной, на оптических свойствах, близких к одноосным, на так называемых фигурах удара и давления на спайных пластинках. Слоистое строение кристаллической решетки обусловливает замечательное свойство этих минералов расщепляться на тонкие листочки. Степень упругости этих листочков для разных групп минералов не одинакова, что связано с химическим их составом, находящим свое отражение на деталях строения кристаллических решеток. На этом вопросе необходимо остановиться подробнее. Обратимся к кристаллической структуре талька (Mg3[Si4O10][OH]2).
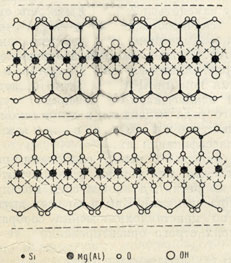
Рис. 326. Кристаллическая решетка талька (или пирофиллита) в проекции вдоль оси с
Формула слоя кремнекислородных тетраэдров для всех слюдоподобных минералов, как мы знаем, выражается радикалом [Si2O5]∞, прячем активные концы всех тетраэдров (рис. 325) обращены в одну и ту же сторону. Два таких гексагональносетчатых слоя, активными сторонами обращенных друг к другу, сцеплены в один плоский пакет с помощью "бруситового" слоя из Mg[OH]2, располагающегося между ними (рис. 326 и 327) и нейтрализующего общий отрицательный заряд двух слоев [Si2O5]2-. Положительный заряд "бруситового" слоя достигается тем, что при вхождении в решетку он как бы теряет часть гидроксилов (их места занимаются активными ионами кислорода радикалов [Si2O5]).
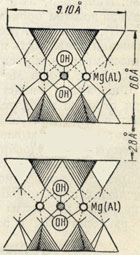
Рис. 327. То же в изображении в виде тетраэдров
Образование такого плоского пакета можно изобразить в виде следующего уравнения:
[Si4O10]+ 3Mg [OH]2-4 [ОН] = = Mg3 [Si4O10] [OH]2 (тальк).
"Бруситовый" слой сможет быть заменен "гидраргиллитовым" слоем- Al[OH]3. Тогда аналогично будем иметь:
[Si4O10] + 2Al [OH]3 - 4 [ОН] = Al2 [Si4O10] [OH]2 (пирофиллит.)
Как в структуре талька, так и в структуре пирофиллита эти пакеты обладают очень прочной внутренней связью, почти полностью компенсированной. Поэтому такие пакеты между собой связаны остаточными очень слабыми вандерваальсовскими силами (на наружных плоских сторонах пакетов кислородные ионы в каждом тетраэдре SiO4 связаны с двумя ионами Si и, следовательно, не остается активной валентной связи для прочного сочленения пакетов между собой). Этим объясняются очень низкая твердость талька и пирофиллита, их необычайно легкая расщепляемость на эластичные пластинки и, наконец отсутствие упругости в последних.
В тех минералах, в которых часть ионов Si4+ заменяется ионами Аl3+ (в той же четверной координации), мы наблюдаем уже существенное изменение свойств. Замена одного иона Si4+ на ион Аl3+, так же как и в амфиболах, приводит к увеличению отрицательного заряда в анионном радикале на единицу. Это означает, что наружные плоские стенки пакета становятся активными. Для нейтрализации этого приобретенного заряда в пространство между пакетами входят одновалентные крупные катионы К1+, могущие располагаться лишь в больших "пустотах" против центров гексагональных, вернее дитригональных (по Н. В. Белову), колец в кремнекислородных слоях в шестерной, а не в двенадцатеричной координации, как это считали ранее. В итоге получаем относительно прочно связанные между собой пакеты. Отсюда, как следствие, твердость таких минералов (типичных слюд) значительно выше, чем талька; отщепляемые тонкие листочки обладают упругостью, т. е. способностью при изгибании возвращаться в прежнее положение.
Если в анионном радикале Si4O10 два иона Si4+ заменены двумя ионами Аl3+, то отрицательный заряд в нем возрастает до 2. В этом случае он может быть компенсирован уже двухвалентными катионами, например Са2+, ионы которого (меньшие по размерам) располагаются в иных местах, нежели ионы К. Это обстоятельство, т. е. увеличение прочности связи между пакетами, более существенно изменяет свойства слюдообразных минералов: твердость возрастает, расщепляемость затруднена, отщепляемые пластинки ломки, почему и было дано этой группе минералов название хрупких слюд.
Для минералов рассматриваемого подкласса особый интерес представляет также вопрос об изоморфных замещениях. Кроме обычных изовалентных замещений ионов Mg2+ ионами Fe2+, Ni2+ и др., а также ионов Аl3+ ионами Fe3+, Сr3+ и др., широко распространен способ замещения ионами иной валентности, но в таких количествах, чтобы общий заряд оставался одним и тем же. Например, 3Mg2+ могут заменяться 2Аl3+. Однако, по сути дела, такая замена должна происходить "скачкообразно" (Mg12 - Mg9Al2-Mg6Al4- Mg3Al6-Al8), хотя практически по химическим анализам эти скачкообразные изменения улавливать не удается. Следует заметить, что подобная замена ионов имеет место в "брусито-гидраргиллитовых" слоях пакетов, в которых при замене трех ионов Mg2+ двумя ионами Аl3+ одно место остается незанятым. Физические свойства, за исключением оптических и удельного веса, при этом не меняются. Этого рода изменение в химическом составе относящихся"сюда минералов является одним из важных признаков, на которых основывается классификация их.
В некоторых слюдообразных минералах между слоистыми пакетами, обладающими слабой остаточной связью, как увидим, располагаются "брусит-гидраргиллитовые" пакеты (в хлоритах), а иногда слои молекул Н2O (в гидрослюдах и им подобных образованиях). Как и во всех других водных минералах, молекулы Н20, по кристаллохимическим соображениям, должны располагаться в этих слоях строго ориентированно.
|
ПОИСК:
|
© GEOMAN.RU, 2001-2021
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'