
1. Группа льда
Как известно, вода в природе находится в трех состояниях: твердом (лед, снег), жидком (дождь, минеральные источники, реки, озера, моря и океаны) и газообразном (водяной пар в атмосфере и вулканических эксгаляциях). По своим свойствам вода стоит особняком среди окислов металлов и металлоидов. Вода играет огромную роль в химических процессах, совершающихся в земной коре: химические реакции происходят главным образом в водных растворах. Без воды, так же как и без кислорода, не мыслимо существование и органической жизни на Земле.
Это соединение мы рассмотрим лишь в твердом и жидком состояниях, широко распространенных в природе.
Лед - Н2O. Химический состав. Н 11,2%, 0 88,8%. Иногда содержит газообразные и твердые механические примеси.
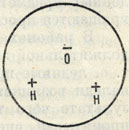
Рис. 143. Строение молекулы Н2O. Протоны Н1+ располагаются внутри иона кислорода
Сингония гексагональная; дигексагонально-пирамидальный в. с. Кристаллическая структура. Лед обладает молекулярной кристаллической структурой с координационным числом 4. Строение самой молекулы Н2O характеризуется следующей особенностью: протоны Н1+,как ионы, не обладающие собственными электронами и имеющие совершенно ничтожные размеры, внедряются глубоко внутрь иона кислорода (рис. 143). Соответственно этому атомное ядро кислорода несколько смещается от центра (на рис. 143 его положение показано маленьким кружочком при сохранении общей сферической формы иона кислорода). Этим и обусловливается дипольный момент в молекуле Н2O. Модель ее упрощенно можно представить в виде тетраэдра, две вершины которого заряжены положительно, а другие две - отрицательно. В силу этого в структуре льда слабо связанные между собой молекулы Н2O ориентированы таким образом, что положительно заряженные участки одних молекул направлены к отрицательно заряженным участкам других молекул. По общему расположению молекул структура льда аналогична структуре вюртцита, с той лишь разницей, что места Zn и S заняты молекулами Н2O. При таком строении (с низким координационным числом, равным 4) получается далеко не плотная упаковка структурных единиц (остаются большие просветы). Этим и объясняется то, что удельный вес льда ниже, чем воды. Облик кристаллов. Кристаллические образования снежинок, обладающих гексагональной симметрией, чрезвычайно разнообразны по формам шестилучевых фигур роста. Широко известны также дендриты и узорчатые образования льда. В ледяных пещерах кристаллы льда встречаются в виде правильных шестиугольных пластинок, таблитчатых индивидов и сложных по форме сростков. Агрегаты. В сплошных массах нередко наблюдаются кристаллически-зернистые агрегаты (плотный снег, фирн в ледниковых районах). Глетчерный лед состоит из очень крупных, неправильных по форме кристаллических зерен. Всем хорошо известны также натечные формы сосулек, образующихся из переохлажденной воды на теневой стороне крыш при таянии снега, а также в ледяных пещерах (сталактиты и сталагмиты). В граде, выпадающем из туч в грозовые периоды, нередко можно наблюдать концентрически-слоистое строение. В морозные осенние утра часто образуются выцветы на земле (иней).
Цвет. Лед бесцветен или слабо окрашен в голубоватый цвет (в больших массах). Блеск стеклянный. Оптически положительный. Показатель преломления очень низкий: Ng = 1,310, Nm = 1,309.
Твердость 1,5. Хрупок. Спайностью не обладает. Уд. вес 0,917 (меньше, чем у воды). Уменьшение удельного веса при кристаллизации свойственно также металлическому висмуту.
Происхождение. Лед образуется на поверхности водных бассейнов при охлаждении воды. Возникающая вначале ледяная каша смерзается в плавающую корочку, на которой снизу нарастают кристаллические индивиды, вытягивающиеся в вертикальном направлении вдоль шестерных осей симметрии. Снег образуется в холодных областях атмосферы за счет водяного пара. При тех же условиях появляются иней и ледяные узоры на охлажденных предметах. В ледяных пещерах с низкой температурой в лед превращаются просачивающиеся по трещинам поверхностные воды.
В районах вечной мерзлоты с суровым климатом, малоснежной продолжительной зимой в зимнее время образуются так называемые "наледи", т. е. ледяные покровы иногда на огромных по размерам площадях. Речные наледи возникают при полном промерзании реки в мелких местах, в результате чего текучие воды вынуждены искать выхода на поверхность, пропитывая снежные покровы. Другие наледи образуются за счет глубинных вод, выходящих из-под толщ вечной мерзлоты в виде не замерзающих зимой ключей. На происхождении ледников и глетчерных льдов останавливаться не будем.
Месторождения льда общеизвестны. Из ледяных пещер, встречающихся в районах с холодной длинной зимой и коротким летом, отметим известную у нас Кунгурскую пещеру (Молотовская область), привлекающую многочисленных туристов красотой множества сверкающих на сводах кристаллов. Из ледниковых пещер зарубежных стран наиболее замечательна пещера Добшивы (Словакия), в которой свыше 7000 м2 покрыто льдом. Общий объем льда составляет 120 000 м3. Ледяные стены достигают 15 м высоты.
Практическое значение. Лед применяется в холодильном деле и для различных целей в быту и технике. В суровых холодных районах, где зимой нет возможности достать воду для питья, последняя получается из мощного речного и озерного льда.
Вода - Н2O. По химическому составу и по происхождению среди природных вод различают следующие главные разновидности:
- морские воды, с растворенными в них хлористыми и сернокислыми солями Na, Mg и др. (около 3,5%),
- пресные речные и озерные воды;
- поверхностные дождевые и грунтовые воды;
- подземные воды;
- воды минеральных источников, классифицирующиеся по растворенным в них минеральным веществам(углекислые, сероводородные, железистые и пр.).
Грунтовые подземные воды, содержащие в значительных количествах известковые соли, носят название жестких вод, в отличие от мягких, бедных ими.
Физические и химические свойства. Чистая вода, как известно, наибольший удельный вес, равный 1, имеет при 4°. Плотность водяного пара по отношению к воздуху равна 0,62. Критическая температура для чистой Н2O равна 374°, критическое давление 217 am. Труднолетучие растворенные вещества, взаимодействующие с водой, сильно понижают упругость паров и повышают критическую точку.
Вода является средой и важнейшим агентом химических реакций, происходящих в земной коре. Растворяющая способность ее играет огромную роль в переносе химических соединений элементов в виде истинных или коллоидных растворов (золей) при эндогенных и при экзогенных процессах минералообразования. Испарение ее, так же как и падение температуры, обусловливает выпадение из насыщенных растворов кристаллических осадков. При этом в ряде случаев вода входит в состав кристаллогидратов как кристаллизационная, в определенных стехиометрических отношениях.
Электролитическая диссоциация воды на ионы Н1+ и [ОН]1- играет важную роль в процессах гидролиза растворенных солей с образованием гидроокислов, основных и кислых солей.
В гидрогелях вода является важнейшей составной частью, адсорбируясь на поверхности тонкодисперсных коллоидных частиц.
При всех метаморфических процессах вода, как и углекислота, играет роль минерализатора. Даже незначительное ее содержание в твердых средах способствует процессам перекристаллизации минеральных веществ.
Происхождение. При экзогеннных процессах на самой поверхности Земли и в атмосфере огромные массы воды находятся в беспрерывном круговороте, испаряясь с поверхности морей, океанов и особенно через растительный лесной покров в атмосферу и вновь выпадая в виде атмосферных осадков. К водам поверхностного происхождения или, как их иногда называют, вадозовым водам относятся почвенные, грунтовые, артезианские и подземные воды, а также многие ключи и минеральные источники.
Значительные количества воды принимают участие и в эндогенных процессах минералообразования. При вулканических извержениях весьма большие массы перегретого водяного пара улетучиваются в атмосферу. При кристаллизации магм в глубинах Земли освобождаются также огромные количества воды, насыщенной различными растворенными соединениями. С этими так называемыми ювенильными водами связаны некоторые горячие минеральные источники (в областях сравнительно молодой вулканической дея-тельности, например в Калифорнии).
Практическое значение. Огромное значение воды в жизни органического мира и в деятельности человека общеизвестно. Для развития растений почва должна содержать 40-60% влаги. В человеческом теле ее до 70%. Суточное поглощение воды человеком в среднем равно 2,5-3 л. Водные ресурсы широко используются человечеством для самых разнообразных технических целей (в паросиловом хозяйстве, гидроэлектростанциями, для мелиорации, в обогащении руд, в химических производствах, в качестве путей сообщения и т. д.). Многие минеральные источники обладают целебными свойствами. Таковы, например, углекислые источники Нарзана, Карловых Вар, Бадена, и др.; железистые источники Железноводска; серные источники Мацесты
|
ПОИСК:
|
© GEOMAN.RU, 2001-2021
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'