
I класс. Фториды
Фториды как минералы имеют довольно ограниченное распространение в природе, хотя общее число элементов, участвующих в соединениях с фтором, достигает 15. Главное значение из них имеет фторид Са в виде самостоятельного соединения СаF2. Гораздо меньшая роль принадлежит В, А и Si. Остальные элементы входят в состав крайне редких минералов.
Установленные до сих пор более широко распространенные фториды встречаются преимущественно в гидротермальных образованиях, а редкие - в продуктах возгона при вулканических извержениях. Судя по парагенезису минералов, они образуются при относительно повышенных температурах. Лишь CaF2 в виде новообразований рассеянных мельчайших кристалликов нередко встречается также в зонах окисления рудных месторождений и в некоторых осадочных породах.
Среди относящихся сюда природных соединений рассмотрим следующие два минерала: флюорит и криолит.
Флюорит - CaF2. "Флюорум" - латинское название элемента F. Синоним: плавиковый шпат*. Этот минерал, как и другие богатые фтором минералы, является хорошим флюсом для руд, ускоряя их плавление.
*(Шпатами в минералогии называют кристаллические вещества, не имеющие металлического блеска, но обладающие совершенной спайностью по двум или более направлениям)
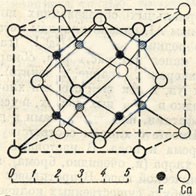
Рис 134. Кристаллическая решетка флюорита
Химический состав. Са 51,2%, F 48,8%. Иногда содержит в виде изоморфной примеси Сl (главным образом желтые разности). В некоторых случаях обнаруживаются битуминозные вещества, издающие запах. Из других примесей укажем Fe2O3, редкие земли, изредка уран (до нескольких процентов), фтор и гелий.
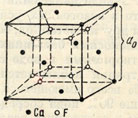
Рис. 135. Кристаллическая решетка флюорита
Сингония кубическая; гексаоктаэдрический в. с. 3L44L636L29PC. Кристаллическая структура является типической для многих соединений типа АХ2. Она характеризуется двумя координационными числами: для Са-8 и для F-4 (рис. 134). Ионы Са2+ расположены так, как в гранецентрированном кубе (по углам и в центрах граней). Ионы F1- занимают центры всех малых кубов (рис. 135). Облик кристаллов. В пустотах встречается в виде хорошо образованных кубических (рис. 136), реже октаэдрических и додекаэдрических кристаллов. Кроме форм {100), {111} и {110), иногда присутствуют {210}, {421} и др. Кристаллы в редких случаях достигают 20-25 см в поперечнике. Грани куба обычно гладкие, а октаэдрические грани-матовые. Иногда грани куба исштрихованы параллельно четырем ребрам или образуют паркетообразный рисунок (см. рис. 17). Двойники часты по (111). Агрегаты. Чаще наблюдается в виде вкраплений и сплошных зернистых, реже землистых, масс (ратовкит).

Рис. 136. Друза кубических кристаллов флюорита
Цвет. Флюорит редко бывает бесцветным и водяно-прозрачным. Большей частью окрашен в различные цвета: желтый, зеленый, голубой, фиолетовый, иногда фиолетово-черный. Любопытно, что окраска исчезает при нагревании, и вновь возвращается при облучении рентгеновскими лучами. В бесцветных кристаллах можно вызвать фиолетовую окраску также действием паров металлического кальция и электрическими разрядами. Это наводит на мысль, что в ряде случаев цвет обусловлен появлением в кристаллической структуре электрически нейтральных атомов Са и F. Блеск стеклянный. N = 1,434.
Твердость 4. Хрупок. При продолжительном одностороннем давлении обнаруживает пластическую деформацию. Спайность совершенная по октаэдру, а не по ромбическому додекаэдру, как это можно было бы ожидать, исходя из представлений о том, что наименьшее сцепление должно иметь место для плоских сеток с наибольшими расстояниями друг от друга. Объясняется это тем, что среди плоских сеток (111) каждая сетка ионов кальция переслоена двумя параллельными сетками одинаково заряженных ионов фтора, чем и обусловливается наименьшее сцепление именно между ними. Уд. вес 3,18 (у нечистых разностей колеблется в пределах 3,0-3,2). Прочие свойства. Часто проявляется флюоресценция (термин произошел именно от названия этого минерала). В катодных лучах флюорит светится обычно фиолетовым цветом со своеобразным синевато-зеленым оттенком. Свечение появляется также при нагревании (термолюминесценция).
Диагностические признаки. После некоторого навыка узнается довольно легко по формам кристаллов, октаэдрической спайности, слабому слегка тусклому стеклянному блеску и твердости.
П. п. тр. растрескивается, светится и с трудом оплавляется по краям (1270°). По выделении всего фтора образуется неплавкая известь (СаО). Весьма слабо растворим в воде. Вполне разлагается лишь в крепкой H2SO4 с выделением HF. HNO3 и НСl действуют гораздо слабее.
Происхождение. В главной своей массе образуется при гидротермальных процессах, часто являясь спутником рудных металлически минералов в жилах. Может встречаться в ассоциации с самыми разнообраз ными минералами гидротермального происхождения.
Он наблюдается также в некоторых породах осадочного происхождения, но не образует значительных скоплений с высоким содержа нием F. Как трудно растворимое в воде соединение, CaF2 из соленосны растворов выпадает одним из первых, иногда в аморфном виде. Поэтом не удивительно, что редко встречающиеся скопления флюорита приурочен: к ранним химическим осадкам, т. е. к отложениям гипса, ангидрит, кальцита, доломита. Изредка в виде новообразований он наблюдается зоне окисления рудных месторождений, например в виде кристалликов на натечном гётите.
Практическое значение. В значительной своей части (около 70%) флюорит используется в металлургии с целью получения более легкоплавких шлаков. В химической промышленности из флюорита получают ряд фтористых соединений, из которых плавиковая кислота (раствор HF в воде употребляется для гравирования на стекле, получения перекиси водорода из перекиси натрия и т. п., а искусственно получаемый криолит (Na3AlF6) - для получения электролизом металлического алюминия из глинозема и для других целей. Применяется также в керамике для получения эмалей и глазури. Прозрачные бесцветные разности кристаллов используются в оптике для изготовления линз, устраняющих сферическую и хроматическую аберрации в объективах микроскопов.
Месторождения. Как спутник флюорит встречается в многочисленны месторождениях цветных и редких металлов. Из месторождений СССР, в которых флюорит играет главную роль, отметим Калангуй (Забайкалье в виде мощной брекчиевой жилы в песчаниках и сланцах, сложенной кoнцентрически-зональными и шестоватыми агрегатами флюорита разных оттенков (белого, желтого и красновато-желтого). Землистый флюорит осадочного происхождения (ратовкит) встречен в доломитизированных известняках по берегам речки Ратовки у г. Вереи (Московская область), на правом берегу р. Осуги (Калининская область) и в других местах.
Криолит - Na3AlF6. "Криос" по-гречески - лед, "литоc" - камень. Очевидно, назван по сходству со льдом, к которому по блеску и показателю преломления действительно очень близок.
Химический состав. А1 12,8%, Na 32,8%, F 54,4%. Иногда в качестве примеси присутствует Fe•••.
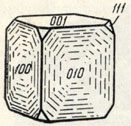
Рис. 137. Кристалл криолита
Сингония моноклинная; призматический в. с. L2PC. Псевдокубический; при температуре около 500° становится кубическим. Облик кристаллов кубовидный (рис. 137) при развитии граней {001} и {010}. Двойники наиболее часты по (110). Обычно встречается в сплошных массах, состоящих из крупных неделимых.
Цвет. Бесцветен, но чаще бывает окрашен в серовато-белый, желтоватый или красноватый, изредка черный цвет. Блеск стеклянный. Ng=l,34.
Твердость 2-3. Хрупок. Спайность отсутствует. Уд. вес 2,95 - 3,01. Прочие свойства. При умеренном нагревании наблюдается свечение желтым светом.
Диагностические признаки. Характерны формы кристаллов и слабый стеклянный блеск. Точное установ-ление этого минерала возможно лишь с помощью паяльной трубки и путем измерения оптических констант.
П. п. тр. очень легко плавится, даже в пламени свечи, окрашивая его в красновато-желтый цвет и давая прозрачный королек, превращающийся при остывании в белую эмаль. В стеклянной трубке дает реакцию на фтор. После продолжительного прокаливания на угле остается корка глинозема, которая от раствора азотнокислого кобальта окрашивается в синий цвет. В крепкой H2SO4 растворяется совершенно.
Происхождение. Встречается в пегматитах, образуясь из остаточных растворов, обогащенных фтором.
Практическое значение. Криолит получается обычно искусственно и используется в металлургии алюминия, для изготовления молочно-белого стекла, эмали для железных сосудов и других целей.
Месторождения крайне редки. Крупное промышленное месторождение известно в Западной Гренландии - Ивигтут, среди гранита, превращенного в грейзен в виде большого штока, вертикально уходящего на глубину. Криолит здесь образует сплошные крупнокристаллические массы вместе с другими сложными фторидами, редкими сульфидами, касситеритом и др. В Ильменских горах (Ю. Урал) встречался в одной из топазовых копей в сопровождении хиолита, амазонита и других минералов.
|
ПОИСК:
|
© GEOMAN.RU, 2001-2021
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'