
Раздел III. Галоидные соединения (галогениды)
Общие замечания. Начиная с этого типа соединений мы будем иметь дело с минералами, резко отличающимися по своим свойствам от рассмотренных до сих пор. В подавляющей массе это будут уже соединения с типичной ионной связью, обусловливающей совсем другие свойства минералов. Наиболее яркими представителями их являются галоидные соединения металлов.
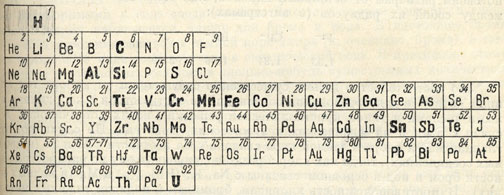
Рис.133.Элементы,для которых характерны соединения с галоидами (набраны жирным шрифтом)
С химической точки зрения относящиеся сюда минералы представлены солями кислот: HF, HCl, НВr и HJ; соответственно этому среди этих минералов различают фториды, хлориды, бромиды и иодиды. Кроме того, существуют водные соли и более сложные соединения, содержащие добавочные кислородсодержащие анионы: [ОН]1-, 02-, изредка [SO4]2-и [JO3]1-. Это так называемые оксигалоидные соединения, переходные к типичным кислородным соединениям.
Как показано в таблице (рис. 133), главные элементы, образующие галогениды, в противоположность тому, что мы имели в ранее рассмотренных минералах, расположены в левой половине менделеевской таблицы, преимущественно в I и II группах. Галоидные соединения тяжелых металлов, наоборот, играют совершенно ничтожную роль в минералогии природных образований и возникают в особых условиях.
Кристаллохимические особенности галоидных соединений. Кристаллические структуры с исчерпывающей детальностью изучены лишь для некоторых простых безводных соединений типа АХ и АХ2, кристаллизующихся в кубической сингонии. При этом установлено, что галогениды легких металлов характеризуются структурами с типичной гетерополярной (ионной) связью, тогда как в соединениях тяжелых металлов, катионы которых обладают сильной поляризацией, возникают гомополярные (ковалентные) или переходные к ним связи между ионами. В соответствии с этим находятся и физические свойства минералов.
Так как в галогенидах с типичной ионной связью принимают участие катионы легких металлов с малыми зарядами и большими ионными радиусами, а в связи с этим с весьма слабой способностью к активной поляризации, то естественно, что эти минералы обладают прозрачностью, бесцветностью (наблюдаемые окраски, как правило, являются аллохроматическими), малыми удельными весами, а также такими свойствами, как необычайно легкая растворимость многих галогенидов в воде, низкие показатели преломления, а следовательно, и слабый стеклянный блеск минералов.
Что касается катионов тяжелых металлов с 18-электронной наружной оболочкой (Сu, Ag и др.), склонных к сравнительно резко выраженной поляризации окружающих анионов и к образованию кристаллических решеток с гомополярной связью, то здесь мы наблюдаем уже существенные отличия в свойствах галогенидов: высокие удельные веса, наличие у ряда соединений хотя и слабой, но идиохроматической окраски, сильно повышенные показатели преломления, алмазный блеск, резко пониженная растворимость этих минералов и др.
ТепеРb перейдем к характеристике свойств, зависящих от главных анионов в галогенидах: F1-, Cl1-, Br1- и J1-.
Прежде всего следует отметить, что анион F1- значительно отличается по своим размерам от остальных анионов, как это видно из сопоставления между собой их радиусов (в ангстремах):
| F1- | Cl1- | Br1- | J1- |
| 1,33 | 1,81 | 1,96 | 2,19 |
Это обстоятельство весьма существенно сказывается на выборе тех или иных катионов для образования соединений (в соответствии с координационными числами и типом кристаллической решетки), на их устойчивости, а в связи с этим и на физических и химических свойствах. Не случайно, что главная масса фтора в земной коре связана с Са и отчасти с А1 и Si (в двойных соединениях), тогда как хлор и резко подчиненные ему по распространенности бром и иод в основном связаны с Na, К, (Rb), (Cs) и Mg (в водных солях). В противоположность хлоридам, бромидам и иодидам тяжелых металлов (Au, Ag, Hg и др.) фториды их вовсе не встречаются в природных условиях. Хлориды легких металлов чрезвычайно легко растворяются в водной среде, тогда как фториды их в большинстве своем устойчивы по отношению к воде. Насколько велика разница в растворимости этих типов соединений, можно видеть из данных, приводимых в табл. 5.
| Анионы | Катионы | |||||||
| Li | Na | K | Mg | Ca | Sr | Ba | Pb2+ | |
| F | 0,11 | 1,06 | 12,4 | 0,02 | 0,03 | 0,001 | 0,03 | 0,003 |
| Cl | 13,1 | 5,42 | 3,9 | 5,1 | 5,4 | 3,0 | 1,7 | 0,05 |
| Br | 12,6 | 6,9 | 4,6 | 4,6 | 5,2 | 3,4 | 2,9 | 0,02 |
| J | 8,5 | 8,1 | 6,0 | 4,1 | 4,8 | 3,9 | 3,8 | 0,02 |
Температуры плавления и кипения фторидов несравненно выше, чем хлоридов тех же металлов. Например, температура кипения SnF4 равна 705°, a SnCl4-114°, фторид алюминия AlF3 кипит при температуре выше 1000°, а хлорид его АlСl3-при температуре всего лишь 81° и т. д.
Крайне интересны геохимические черты галоидов F, G1, Вr и J, выражающиеся в поведении их при различных геологических процессах.
При магматических процессах не создается условий для концентрации этих элементов в сколько-нибудь значительных количествах. Фтор и хлор лишь в качестве добавочных анионов входят в ряд минералов, преимущественно силикатов и фосфатов (большей частью в пегматитах и вконтактово-метасоматических образованиях). Главная масса этих элементов, очевидно в виде летучих соединений с металлами, переходит в гидротермальные растворы. О том, что хлор и фтор действительно являются составной частью летучих погонов магм, свидетельствуют выделения НСl и HF в газообразных продуктах вулканических извержений, иногда в весьма значительных количествах. Например, на Аляске в долине, известной под названием "Десять тысяч дымов", в 1919 г., по подсчетам, выделилось 1,25 млн. т газообразной НСl и 0,2 млн. т HF вместе с парами Н2O.
Из галогенидов во многих гидротермальных образованиях широко представлен CaF2 (флюорит), отчасти фториды Аl, однако хлориды металлов не встречаются, если не считать крайне редких находок NaCl (галита) в виде микроскопических кристалликов в капельках растворов, обнаруживаемых в виде включений в некоторых минералах (кварце, галените).
Зато в экзогенных условиях хлориды Na, в меньшей степени хлориды, К, Mg и других металлов, образуются, нередко в огромных массах, в усыхающих соленосных бассейнах вместе с сульфатами, иногда боратами и другими растворимыми в воде соединениями. Вместе с хлором соответствующая концентрация наблюдается также для брома и иода. В настоящее время 70-75% всего имеющегося в земной коре хлора (и, очевидно, брома), а также свыше 90% иода сосредоточено в океанической воде. В противовес этому фториды в соленосных осадках в сколько-нибудь существенных количествах не наблюдаются. Гигантскими коллекторами растворенных хлоридов, как известно, являются океанические и морские бассейны. Однако содержание фтора в морской воде совершенно ничтожно: около 0,8 г на 1 м3, причем, как установлено, этот элемент частично усваивается организмами и входит в состав костяка высших животных, особенно в состав зубной эмали, состоящей почти исключительно из фтористого кальция.
Для миграции фтора в экзогенных условиях характерна еще одна особенность. В процессе выветривания горных пород и рудных месторождений, в общей сложности, наряду с хлором освобождаются немалые количества этого элемента, но химическое сродство его к кальцию настолько велико, что по пути следования к морским бассейнам он в значительной мере выпадает из растворов с образованием труднорастворимого соединения CaF2 и задерживается в континентальных осадках. Этим и объясняется совершенно незначительное содержание его в морской воде.
О классификации галогенидов. Таким образом, все, что сказано о свойствах галогенидов и о геохимической роли галоидов при процессах минералообразования, заставляет все минералы, относящиеся к данному разделу, разбить на два класса:
- I класс. Фториды.
- II класс. Хлориды, бромиды и иодиды.
|
ПОИСК:
|
© GEOMAN.RU, 2001-2021
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'