
Раздел II. Сульфиды, сульфосоли и им подобные соединения
Общие замечания. К рассматриваемому разделу относятся сернистые, селенистые, теллуристые, мышьяковистые и сурьмянистые соединения металлов. К ним принадлежит весьма значительное количество важных в промышленном отношении минералов, играющих существенную роль в составе многочисленных месторождений металлических полезных ископаемых.
Наибольшее число минералов представлено сернистыми соединениями (сульфидами, сульфосолями)*. Все они, за исключением сероводорода, в природе распространены в твердом состоянии.
*(Сульфосолями называют соли гипотетических сульфокислот, в которых роль сульфоангидридов играют As2S3, Sb2S3, Bi2S3 и др.)
Общее количество химических элементов, дающих в том или ином виде соединения с серой, достигает 40. Главнейшие из них следующие: Н, V, Мn, Fe, Ni, Со, Сu, Zn, (Ga), Ge, As, Mo, Ru, (Rh), (Pd), Ag, Cd, (In), Sn, Sb (Re), (Os), (Ir), Pt, Hg, Tl, Pb и Bi. В скобках показаны элементы, не дающие самостоятельных сернистых соединений, а встречающиеся лишь в виде изоморфных примесей.
Общее весовое количество сернистых соединений, по приблизительному подсчету В. И. Вернадского, составляет максимум 0,15% (к весу земной коры), причем главенствующее значение из металлов в этих соединениях имеет Fe. Сернистые соединения всех остальных элементов, не считая сероводорода, в весовом отношении в земной коре составляют ничтожный процент (около 0,001%). Из них типичные соединения с серой образуют: Zn, Pb, Сu, Ag, Sb, Bi, Ni, Co, Mo и Hg.
Селенистые соединения (селениды) известны для следующих элементов: Н, Сu, Ag, Hg, Pb и Bi. Кроме того, селен нередко присутствует в сернистых соединениях в виде изоморфной примеси к сере.
Теллуристые соединения (теллуриды) по сравнению с селенидами пользуются в природе несколько более широким распространением, хотя число элементов, соединяющихся с теллуром, все же ограничено. Эти элементы: Сu, Ag, Au, Hg, Pb, Bi, Ni и Pt. Все они образуют самостоятельные минералы.
Мышьяковистые простые соединения (арсениды) установлены для следующих немногих элементов: Fe, Ni, Со и Pt. Более широко распространены сложные соединения в виде сульфосолей-сульфоарсенитов, главным образом для следующих металлов: Сu, Ag и Pb.
сурьмянистые простые соединения (антимониды) известны лишь для Ni. Зато часто устанавливаются сложные соединения - сульфоантимониты Сu, Ag и Pb.
Висмутистые простые соединения в природе не известны. Наблюдаются лишь сульфовисмутиты Сu, Ag и Pb.
Количественное значение селенистых, теллуристых, мышьяковистых, сурьмянистых и висмутистых соединений несравненно меньше, чем сернистых соединений.
Химические особенности соединений. Если мы обратимся к таблице химических элементов Д. И. Менделеева, то заметим, что сернистые соединения характерны для элементов, располагающихся почти исключительно в правой части этой таблицы, особенно для металлов так называемых побочных рядов периодической системы. То же самое можно сказать и о селенистых, теллуристых, мышьяковистых и других соединениях.
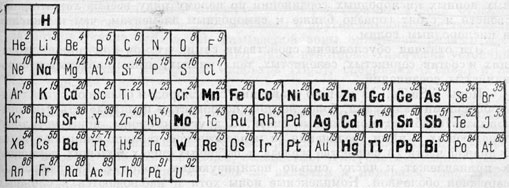
Рис. 88. Элементы, для которых характерны сульфиды и им подобные соединения (набраны жирным и полужирным шрифтом)
В левой части таблицы особняком стоит лишь водород, сернистое соединение которого (H2S) является аналогом воды и играет огромную роль в образовании сульфидов металлов.
Явно выраженное сродство серы с тяжелыми металлами проявляется в том, что она образует с ними почти нерастворимые в воде сернистые соединения. В противоположность им, подобные же соединения легких металлов (Na, К, Mg, Са и др.) устанавливаются лишь в растворенном состоянии в водах.
В химическом отношении рассматриваемые здесь соединения сравнивают с кислородными соединениями - простыми окислами и кислородными солями. Действительно, в химических формулах этих типов соединении имеются общие черты (например: Cu2O и Cu2S, HgO и HgS, Sb2O3 и Sb2S3, Cu3AsS4 и Cu3[ASO4]2 и т. д.).
Большинство простых сернистых, селенистых и теллуристых соединений с химической точки зрения являются производными H2S, H2Se и Н2Те (например, Cu2S, ZnS, HgSe, PbS, PbTe, Sb2S3 и др.).
В сложных сернистых соединениях эти простые сульфиды образуют или двойные соединения, или такие, которые с химической точки зрения приходится относить к особому классу сульфосолей.
Кроме того, распространены простые соединения типа АХ2-дисульфиды, которые В. И. Вернадский относит к производным H2S2. Сравнивая с окислами, он считает их аналогами перекисей. Действительно, дисульфиды при нагревании легко отдают часть серы, подобно перекисям, теряющим часть кислорода.
Арсениды и антимониды (простые соединения металлов с мышьяком и сурьмяой) существенно отличаются по химической природе от сернистых соединений. Ни мышьяк, ни сурьмяа не могут являться изоморфными заместителями серы, как это принималось в старое время. К таким соединениям относятся, например, NiAs, NiSb, FeAs2, CoAs3, и др. К дисульфидам и диарсенидам очень близки по химическим и физическим свойствам также сульфоарсениды (FeAsS и др.) и сульфоантимониды (NiSbS и др.).
Многие соединения из рассматриваемого класса образуют друг с другом твердые растворы в виде непрерывных рядов или с ограниченной смесимостью в твердом состоянии. К ним, например, можно отнести ряды: HgS-HgSe, CoAs2-NiAs2-FeAs2 и многие другие. Наконец, широко распространены полиморфные модификации.
Особенности кристаллического строения и физические свойства. Как показывают имеющиеся данные рентгенометрических исследований, сульфиды и им подобные соединения должны быть отнесены к ионным соединениям, но в то же время они в большинстве своем сильно отличаются от типичных ионных кислородных соединений по целому ряду весьма характерных свойств и стоят гораздо ближе к самородным элементам, чем к окислам и кислородным солям.
Эти отличия обусловлены свойствами самих атомов или ионов, входящих в состав сернистых, селенистых, теллуристых, мышьяковистых и сурьмянистых соединений.
Ионы S,Se,Te, As и Sb по сравнению с кислородом обладают существенно большими радиусами, более легкой способностью поляризоваться и образовывать слабые гомополярные связи. С другой стороны, ионы металлов, образующих с ними соединения, в менделеевской таблице занимают места в правой части (в семействе железа и побочных рядах больших периодов) и принадлежат к числу сильно поляризующих ионов с 18-электронной наружной оболочкой. Комплексные ионы хотя и наблюдаются в сложных сернистых соединениях - сульфосолях, но не обладают столь прочными связями, как это имеет место, например, в силикатах и других кислородных солях.
Явление поляризации приводит к тому, что в кристаллических решетках происходит значительное объединение электронов соседних противоположно заряженных ионов, о чем можно заключить по явно выраженному для большинства сульфидов и подобных им соединений металлическому блеску, свойственному вообще типичным металлам. С этим легко увязывается также и электропроводность большинства сернистых, мышьяковистых и прочих соединений. Этим объясняются и наблюдающийся иногда недостаток атомов металлов по сравнению с атомами металлоидов (например, в пирротине - Fe1-хS), нередкое отсутствие строгих дальтоновских соотношений в составе минералов и т. д.
В соединениях с S, Se, Те металлические свойства увеличиваются по мере замены серы селеном и теллуром. В ряду семейства железа усиление этих свойств происходит по мере приближения от Мn к Ni. То же самое мы можем заметить в ряду As, Sb и Bi, где металлические свойства усиливаются по мере приближения к висмуту. Действительно, висмутин (Bi2S3) характеризуется более сильным металлическим блеском, нежели антимонит (Sb2S3), тогда как аурипигмент (As2S3) полупрозрачен и обладает лишь алмазным или полуметаллическим блеском.
Об условиях нахождения в природе. Подавляющая масса скоплений сернистых и им подобных соединений наблюдается в рудных месторождениях гидротермального происхождения. Это обстоятельство и служит основанием к предположению о том, что тяжелые металлы из магматических очагов выносятся в виде летучих или легкоподвижных соединений и выпадают в условиях пониженных давлений и температур преимущественно в виде сернистых соединений. На основании экспериментальных данных допускают, что перенос этих соединений в гидротермальных растворах мог совершаться как в виде коллоидных растворов (золей) в присутствии H2S, так и в виде легкорастворимых, неустойчивых при низких температурах двойных солей с сернистыми щелочами или сульфогидратами их (NaHS, KHS и др.), в которых легко растворяется и золото, как это показал Беккер. При распаде этих соединений при низких температурах могли образоваться обычные сульфиды металлов и золото в самородном виде (сульфиды его не известны в природе, хотя селениды и теллуриды встречаются).
В иных условиях происходит образование сульфидов в осадочных глинистых породах, а также в битуминозных и угленосных отложениях. Обычными сульфидами в этих породах являются пирит и марказит (FeS2). Они образуются в восстановительных условиях при наличии H2S, возникающего в результате разложения органических веществ без доступа кислорода или при недостатке его и во многих случаях, повидимому, не без участия бактерий.
При процессах выветривания, т. е. в присутствии воды и кислорода, почти все относящиеся сюда минералы, легко окисляясь, разлагаются, образуя первоначально большей частью легко растворимые в воде сульфаты, а затем гидроокислы, окислы, карбонаты и другие кислородные соединения, характеризующие состав так называемой зоны окисления рудных месторождений. Исключение составляют лишь некоторые химически устойчивые в этих условиях минералы: киноварь (HgS), сперрилит (PtAs2) и лаурит (RuS2).
Классификация сульфидов и им подобных соединений. Основываясь на химической характеристике отдельных типов соединений, все рассматриваемые здесь соединения необходимо прежде всего разделить на два класса:
- I класс. Простые сернистые, селенистые, теллуристые, мышьяковистые и сурьмянистые соединения; сюда же включим и минералы типа двойных соединений.
- II класс. Сульфосоли, т. е. минералы, близкие по химической конституции к солеобразным типам соединений.
|
ПОИСК:
|
© GEOMAN.RU, 2001-2021
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'