
VII класс. Бораты
Общие замечания. К этому классу принадлежат борнокислые соединения - соли борных кислот, к числу которых, кроме ортокислоты HBO3, относятся метаборная кислота HBO2 и так называемые полиборные кислоты.
Эти гипотетические полиборные кислоты выводятся отнятием того или иного количества частиц H2O от соответствующего количества частиц нормальной ортокислоты. В природных условиях более часто встречаются соли следующих борных кислот:
H3BO3-H2O=HBO2
4H3BO3-5H2O=H2B4O7
5H3BO3-6H2O=H3B5O9
5H3BO3-7H2O=HB5O8
6H3BO3-7H2O=H4B6O11
8H3BO3-11H2O=H2B8O13 и др.
Комплексный анион солей ортоборной кислоты [BO3]3-, имеющий форму плоского треугольника, обладает в общем значительно меньшими размерами, чем анионы [PO4]3-, [AsO4]3- и [VO4]3-. Поэтому естественно, что оптимальными катионами для образования прочных кристаллических решеток являются катионы трехвалентных металлов, обладающие относительно малыми размерами. К ним должны быть отнесены прежде всего Al3+, а затем Fe3+ и Mn3+, для которых известны основные соли в сочетании с двухвалентными катионами малых ионных радиусов (Mg, Fe••). Характерны также кислые и основные ортосоли Mg2+, в одном случае в сочетании с Ti4+. Кальций наблюдается только в двойных солях.
Все эти ортобораты встречаются исключительно в виде безводных соединений. Нормальные ортобораты не растворяются не только в воде, но и в кислотах (или разлагаются в них с трудом), плавятся при высокой температуре и обладают высокой или повышенной твердостью.
Для полиборатов в числе катионов, кроме Mg2+, весьма характерны также более крупные катионы Ca2+ и Na1+, причем они распространены почти исключительно в виде водных солей. Полибораты Na1+ и других сильных катионов легко растворимы в холодной воде, а двойные бораты Na1+ и Ca2+-в горячей воде. Безводные полибораты магния (например борацит) в водной среде постепенно гидратизируются при нормальной температуре, чего не наблюдается для ортоборатов.
Интересны и некоторые другие особенности поведения бора в природных процессах. Как установлено, при низких температурах B2O3 способен вытесняться CO2, при высоких же температурах имеет место обратная картина. При выветривании можно наблюдать явления замещения боратов карбонатами, как было установлено в Индерском месторождении боратов. С другой стороны, в контактово-метасоматических месторождениях известны находки боратов, образовавшихся путем замещения в известняках.
Бор относится к числу довольно подвижных элементов в водных растворах, содержащих такие компоненты, как Cl, ОН и особенно F, с которым он имеет значительное химическое сродство. Поэтому концентрация и образование борных соединений происходят в остаточных продуктах тех или иных геологических процессов, отчасти в пегматитах и гидротермальных образованиях (ортобораты, боросиликаты), но главным образом в обогащенных бором усыхающих соленосных бассейнах (полибораты, изредка водные боросиликаты).
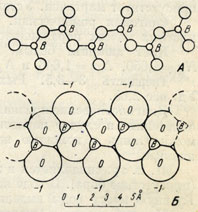
Рис. 268. Цепочки связанных комплексов BO3. А-положение центров ионов; Б-вид цепочки в кристаллической структуре
По ряду кристаллохимических свойств бораты стоят ближе к силикатам, чем к другим кислородным солям. Ортобораты, характеризующиеся наличием в кристаллических структурах изолированных комплексных анионов [BO3]3-, мало чем отличаются от типичных кислородных солей, в том числе и ортосиликатов с их изолированными группами [SiO4]4-. Однако наряду с этим во многих боратах, как и в силикатах, в отличие от других типов солей, устанавливаются более сложные комплексные анионы, состоящие из сочлененных друг с другом групп [BO3]3- с образованием общих вершин треугольников (рис. 268), в результате чего возникают так называемые протяженные анионы в виде отрицательно заряженных цепочек, слоев и т. д., характерные для полиборатов.
|
ПОИСК:
|
© GEOMAN.RU, 2001-2021
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'