
2. Группа гидраргиллита
Сюда относятся так называемые тригидраты некоторых трехвалентных металлов. Наиболее распространен в природе Аl[ОН]3. Гидрат окисного железа Fe[OH]3, образующийся в первые моменты при гидролизе солеи этого металла, не устойчив и быстро подвергается обезвоживанию. Ион Fe3+ в небольших количествах иногда входит лишь изоморфно в состав Аl[ОН]3. В гидратах алюминия также в виде изоморфной примеси присутствует Ga3+ в значительно повышенных против кларка количествах.
Гидраргиллит - Аl[ОН]3. Название происходит от греческих слов "гидор" - вода и "аргиллос" - белая глина. Впервые был установлен еще в прошлом столетии на Урале. Синоним - гиббсит.
Химический состав. Аl2O3 65,4%, Н2O 34,6%. В виде изоморфной примеси устанавливаются Fe2O3 (до 2%), а также Ga2O3 (до 0,006%). Химические анализы часто обнаруживают почти полное совпадение состава с теоретической формулой.
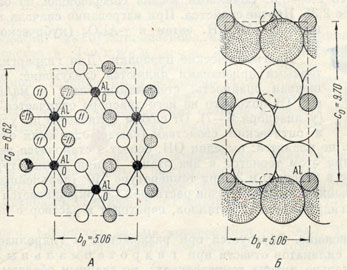
Рис 197. Кристаллическая структура гидраргиллита
Сингония моноклинная; призматический в. с. L2PC. Кристаллическая структура слоистая, близкая к слегка искаженной структуре брусита. Некоторые особенности ее обусловлены тем, что ион алюминия по сравнению с ионом магния обладает большим зарядом и меньшей величиной ионного радиуса. В гидраргиллите, так же как и в брусите, каждый слой состоит из двух листов плотно упакованных гидроксильных ионов, между которыми располагается лист катионов Аl3+ (рис. 197). Так как заряд иона алюминия больше, чем заряд иона магния, то для нейтрализации отрицательного заряда гидроксильных ионов требуется меньшее число катионов Аl+3 . Поэтому катионы Аl3+ занимают не все октаэдрические пустоты между листами ОН, как это имеет место в брусите, а только две трети их. В связи с этим ионы Аl3+ располагаются не в виде центрированных гексагонов, как в решетке брусита. а в виде простых шестиугольников (ср.расположение черных точек на рис. 196 и 197). Если оконтурить такой шестиугольник, то легко видеть, что на него в слое решетки брусита приходится шесть гидроксильных ионов и три полных иона Mg2+ (один центральный ион плюс шесть периферических, каждый по 2/6 валентности), т. е. формула гексагона будет Mg3[OH]6. Для решетки же гидраргиллита, при том же числе гидроксильных ионов, в формуле гексагона будет только два иона Аl3+, т. е. она будет иметь вид Аl2[ОН]6. Различие заключается также в способе сочленения тройных слоев друг с другом: в то время как в структуре брусита каждый ион [ОН]1- приурочивается к центру между тремя ионами [ОН]1- следующего слоя, в структуре гидраргиллита каждый ион [ОН]1- одного слоя противостоит каждому иону [ОН]1-следующего слоя (см. правые части рис. 196 и 197).
Рис. 198. Кристалл гидраргиллита
Облик кристаллов шестиугольнотаблитчатый (рис. 198). Распространены сложные двойниковые сростки по нескольким законам, обычно по (100) и (110). Чаще наблюдается в лучисто-листоватых агрегатах, иногда в натечных формах или в виде бобовидных или шаровидных конкреций. В главной же своей массе на земной поверхности распространен в тонкочешуйчатых или скрытокристаллических массах.
Цвет гидраргиллита белый, или он слабо окрашен в сероватый, зеленоватый и красноватый оттенки. Блеск стеклянный, на плоскостях спайности перламутровый. Ng = 1,587, Nm = 1,566 и Np = 1,566.
Твердость 2,5-3,5. Спайность весьма совершенная по базопинакоиду {001}. Уд. вес 2,35. Прочие свойства. При нагревании сначала превращается в бёмит - АlOОН, затем в γ-Al2O3 (кубической структуры типа шпинели).
Диагностические признаки. Для гидраргиллита характерными признаками являются следующие: весьма совершенная спайность, стеклянный блеск и малый удельный вес. От похожего на него диаспора отличается по твердости (у диаспора 6-7). От слюды отличается по удельному весу и оптическим свойствам (слюды оптически отрицательны). П. п. тр. не плавится; выделяя ОН, белеет и становится непрозрачным. Гидроксил при этом теряется в два этапа:
- при температуре 202-196° (превращение в диаспор) и
- при температуре 510° (дальнейшая дегидратация).
Прокаленный, будучи смочен раствором Со, окрашивается в яркосиний цвет. Как и гидраты других металлов, переходит в раствор в солянокислой вытяжке.
Происхождение. Образуется при разложении и гидролизе алюминийсодержащих силикатов отчасти при гидротермальных процессах (при сравнительно низких температурах), но главным образом при экзогенных процессах выветривания, и притом преимущественно в условиях теплого климата в тропических и субтропических странах.
Гидраргиллит гидротермального происхождения встречается сравнительно редко и в очень небольших количествах. Он наблюдался в некоторых эндогенных месторождениях как один из последних минералов, образовавшихся из низкотемпературных гидротермальных растворов.
При процессах выветривания в жарких странах гидраты глинозема, в том числе и гидраргиллит, образуются обычно совместно с гидратами железа. Гидраргиллит в значительно больших количествах присутствует в так называемых латеритах*, т. е. продуктах выветривания, широко распространенных в пределах современных тропических стран в виде покрова на коренных горных породах и состоящих в основном из гидроокислов, содержащих Fe2O3 и в меньшей степени Аl2O3 и SiO2. Он наблюдается и в бокситах, состоящих преимущественно из гидратов Аl и образующихся также в коре выветривания горных пород.
*("Латер" - кирпич (продукты выветривания по своему цвету напоминают хорошо обожженный кирпич))
Образование бокситов для ряда месторождений приписывают также процессам разложения известняков и доломитов в экзогенных условиях, допуская, что глинистые остатки от выщелачивания могли в щелочной среде подвергаться дальнейшему разложению с выносом освободившегося кремнезема.
При процессах регионального метаморфизма гидраргиллит, обезвоживаясь, переходит в диаспор, а в более глубинных условиях - в корунд (наждак) или, в присутствии SiO2, - в силикаты алюминия или алюмосиликаты.
Практическое значение. Гидраргиллит, так же как и диаспор и бёмит, входящие в состав бокситов, является источником глинозема, из которого, как известно, выплавляется один из наиболее легких металлов - алюминий. Для этих целей используются бокситы с содержанием кремнезема не выше 10-15%.
В химической промышленности применяются маложелезистые (светлой окраски) бокситы с целью получения солей алюминия, главным образом сульфатов. Более низкие сорта бокситов используются для производства абразивов (алунда и алоксита). Из них изготовляются также огнеупоры для высоко-температурных печей (температура плавления выше 2000°). Возрастает применение специальных сортов бокситов в качестве адсорбента при очистке нефтяных и растительных масел, для изготовления красок, в качестве катализаторов и пр.
Месторождения. Как спутник диаспора гидраргиллит установлен в месторождениях боксита в Тихвинском районе Ленинградской области и в других местах. Кристаллы гидраргиллита до 5 см в поперечнике, имеющие минералогическое значение, были встречены среди гидротермальных образований в Шишимских и Назямских горах в Златоустовском районе (Ю. Урал) среди метаморфических сланцев, а также в виде продуктов изменения нефелина в пегматитах Вишневых гор (Средний Урал).
Сассолин - В[ОН]3. Сингония триклинная; пинакоидальный в. с. Наблюдается в тонкочешуйчатых, шестиграннотаблитчатых бесцветных или слабоокрашенных кристалликах. Блеск стеклянный, на плоскостях спайности перламутровый. Оптически отрицательный. Ng =1,459, Nm =1,456 и Np =1,340.
Твердость 1. Спайность весьма совершенная по {001}. Уд. вес 1,48. Легко плавится. Пламя окрашивает в зеленый цвет. В холодной воде растворяется слабо.
Выделяется в виде белых выцветов, как продукт деятельности фумарол в вулканических районах: в больших количествах на о. Вулкано (Липарские острова, у северо-восточного конца о. Сицилия), в трещинах вулкана Авача на Камчатке и других местах. Впервые был найден в Сассо в Тоскане (Италия). В растворенном состоянии гидрат бора часто устанавливается в нефтяных водах и в выбросах грязевых вулканов (на Керченском полуострове и на Кавказском побережье Каспийского моря).
|
ПОИСК:
|
© GEOMAN.RU, 2001-2021
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'