
Глава I. Земная кора и особенности ее состава
Строение земного шара. Главным объектом геологических, в том числе и минералогических, исследований является земная кора*, под которой подразумевается самая верхняя оболочка земного шара, доступная непосредственному наблюдению. Сюда относятся: нижняя часть атмосферы, гидросфера и верхняя часть литосферы, т. е. твердой части Земли.
*(Название "земная кора" дано совершенно условно-оно никакого отношения не имеет к первичной коре остывания земного шара)
Наши фактические знания о строении и химическом составе земной коры основываются почти исключительно на наблюдениях над самыми поверхностными частями нашей планеты. Местами, благодаря шахтным разработкам месторождений полезных ископаемых, известны и более глубокие части земной коры. В золоторудном месторождении Витватерсранд (Южная Африка) наибольшая глубина шахт составляет 2330 м. Самые глубокие нефтяные скважины достигают глубины 4-5 км.
Горообразующие процессы, совершавшиеся в различные геологические эпохи и приводившие к образованию высоких горных хребтов, подняли из глубины самые различные породы, не образующиеся вблизи поверхности Земли. Однако это дает возможность, как показывают геологические наблюдения и подсчеты, получить более или менее реальное представление о составе и строении земного шара только до глубины 16 - 20 км (радиус же его превышает 6300 км).
О строении и составе глубоких недр земного шара можно судить лишь на основании косвенных данных. Как показывает сопоставление плотностей всего земного шара (5,527) и земной коры (2,7-2,8), внутренние части нашей планеты должны обладать значительно большей плотностью, чем поверхностные. Как предполагают на основании различных данных (геофизические наблюдения, данные сравнения Земли с другими космическими телами, состав метеоритов и пр.), это обстоятельство обусловлено не только увеличением с глубиной давления, но и изменением состава внутренних частей нашей планеты.
Наибольшим признанием в настоящее время пользуется гипотеза В. М. Гольдшмидта о строении земного шара. Последний, по его представлениям, состоит из трех главных концентрически расположенных зон (геосфер):
- наружной - литосферы;
- промежуточной - халькосферы, богатой окислами и сернистыми соединениями металлов, преимущественно железа,
- центральной - сидеросферы, представленной железо-никелевым ядром.
Литосфера в свою очередь подразделяется на две части:
- верхнюю оболочку - до глубины 120 км,сложенную в основном обычными силикатовыми породами,
- нижнюю - эклогитовую оболочку (120-1200 км), представленную силикатовыми породами, обогащенными магнием.
По В. М. Гольдшмидту, отдельные геосферы характеризуются следующими данными:
| Мощность км | Плотность | состав | |
|---|---|---|---|
| Атмосфера | несколько сот | 0-0,0015 | N2, O2, H2O, CO2, благородные газы |
| Биосфера | 0-11 | Около 1 | Органические вещества и минералы скелетов |
| Гидросфера | 0-11 | 1 | H2O и др. (океаны, отчасти внутренние воды, снег и лед) |
| Верхняя силикатовая оболочка | 50-120 | 2,73 | Литофильные* элементы: О, Si,*Al, Ca, Mg, Na, К, Li, Rb, Ba и др. |
| Эклогитовая оболочка | 1100 | 3,6-4 | Силикаты, главным образом Mg и Fe |
| Сульфидно-окисная оболочка | 1700 | 5-6 | Халькофильные** элементы: S, Se, Те, Fe, Cu, Zn, Pb, Cd, Hg, Sb, Bi, As, Au, Ag и др. |
| Железо-никелевое ядро | 3500 | 8-10 | Сидерофильные*** элементы: Fe, Ni, Со, группа платины; Mo, Р, С и др. |
*( От греческого слова "литос" - камень; для большинства литофильных элементов характерно сродство к кислороду)
**( От древнегреческого слова "халькос" - медь; для большинства халькофильных элементов характерно сродство с серой)
***(От древнегреческого слова "сидерос" - железо ("метеорит"))
Состав земной коры. Средний химический состав доступной наблюдению земной коры условной мощностью в 16 км, включая сюда гидросферу, биосферу и прилегающую часть атмосферы, подсчитывался многими учеными. Впервые состав твердой части земной коры в весовых процентах подсчитал американский исследователь Ф. Кларк в 1889 г. Большая работа по уточнению полученных цифр была проделана В. И. Вернадским, А. Е. Ферсманом, И. и В. Ноддаками, Г. Гевеши, В. М. Гольдшмидтом и др.
По предложению акад. Ферсмана средние цифры содержаний отдельных элементов в земной коре стали называть "числами Кларка", или просто "кларками". Он же предложил выражать эти величины не только в весовых процентах, но и в атомных.
Из девяноста семи химических элементов, приведенных в периодической таблице элементов Менделеева (табл. 1), лишь немногие пользуются широким распространением в земной коре. Такие элементы в таблице располагаются в верхней ее части, т. е. относятся к числу элементов с малыми порядковыми номерами.
| Периоды | Группы | |||||||||||
| 0 | I | II | III | IV | V | VI | VII | VIII | ||||
| I | 1.HВодород1,0080 | |||||||||||
| II | 2.HeГелий4,003 | 3.LiЛитий6,940 | 4.BeБериллий9,013 | 5.BБор10,82 | 6.CУглерод12,010 | 7.NАзот14,008 | 8.OКислород16,0000 | 9.FФтор19,00 | ||||
| III | 10.NeНеон20,183 | 11.NaНатрий22,997 | 12.MgМагний24,32 | 13.AlАллюминий26,97 | 14.SiКремний28,06 | 15.PФтор30,98 | 16.SСера32,066 | 17.ClХлор35,457 | ||||
| IV | 18.ArАргон39,944 | 19.KКалий39,096 | 20.CaКальций40,08 | 21.ScСкандий45,10 | 22.TiТитан47,90 | 23.VВанадий50,95 | 24.CrХром52,01 | 25.MnМарганец54,93 | 26.FeЖелезо55,85 | 27.CoКобальт58,94 | 28.NiНикель58,69 | |
| 29.CuМедь63,57 | 30.ZnЦинк65,38 | 31.GaГаллий69,72 | 32.GeГерманий72,60 | 33.AsМышьяк74,91 | 34.SeСелен78,96 | 35.BrБром79,916 | ||||||
| V | 36.KrКриптон83,7 | 37.RbРубидий85,48 | 38.SrСтронций87,63 | 39.YИттрий88,92 | 40.ZrЦирконий91,22 | 41.NbНиобий92,91 | 42.MoМолибден95,95 | 43.TcТехнеций99 | 44.RuРунетий101,1 | 45.RhРодий102,91 | 46.PdПалладий106,7 | |
| 47.AgСеребро | 48.CdКадмий | 49.InИндий | 50.SnОлово | 51.Sbсурьмяа | 52.TeТеллур | 53.JИод | ||||||
| VI | 54.XeКсенон131,3 | 55.CsЦезий132,91 | 56.BaБарий137,36 | 57.La*Лантан138,92 | 72.HfГафний178,6 | 73.TaТантал180,88 | 74.WВольфрам183,92 | 75.ReРений186,31 | 76.OsОсмий190,2 | 77.IrИридий193,2 | 78.PtПлатина195,23 | |
| 79.AuЗолото197,2 | 80.HgРтуть200,61 | 81.TlТаллий204,39 | 82.PbСвинец207,21 | 83.BiВислут209,00 | 84.PoПолоний210 | 85.AtАстатий211 | ||||||
| VII | 86.RnРадон222 | 87.FrФранций223 | 88.RaРадий226,05 | 89.AcАктиний227 | 90.ThТорий232,12 | 91.PaПротактиний231 | 92.U**Уран238,07 | |||||
| *58-71. TR-редкие земли (лантаноиды): | **Ураноиды (актиноиды): | ||||||||||||
| 58.CeЦерий140,13 | 59.PrПразеодимий140,92 | 60.NdНеомидий144,27 | 61.PmПрометий147,0 | 62.SmСамарий150,1 | 63.EuЕвропий152,0 | 64.GdГадолиний156,9 | 92.UУран238,07 | 93.NpНептуний237 | 94.PuПлутоний | 95.AmАмериций | 96.CmКюрий | 97.BkБеркелий | 98.CfКалифорний |
| 65.TbТербий158,9 | 66.DyДиспрозий162,46 | 67.HoГольмий164,94 | 68.ErЭрбий167,2 | 69.TuТулий168,9 | 70.YbИттербий173,04 | 71.LuЛютеций174,99 | |||||||
Как видно из диаграммы (рис. 3), наиболее распространенными элементами являются: О, Si, Al, Fe, Ca, Na, К, Mg, Н, Ti, С и Cl. На долю остальных 80 элементов приходится всего лишь 0,71% (по весу).
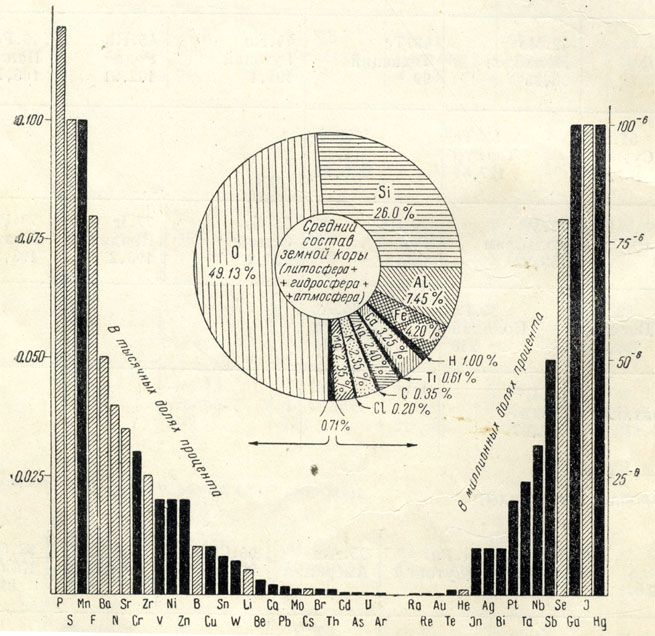
Рис. 3. Диаграмма распространения главнейших элементов в земной коре (литосфера+ гидросфера+часть атмосферы) в весовых процентах В боковых колонках черными столбиками показаны важнейшие металлы
Подавляющее большинство этих элементов в земной коре присутствует почти исключительно в виде химических соединений. К числу элементов, встречающихся в самородном виде, относятся очень немногие. Те и другие возникают в результате химических реакций, которые протекают в земной коре при различных геологических процессах, приводящих к образованию самых разнообразных по составу массивов горных пород и месторождений полезных ископаемых.
Если главнейшие элементы расположить в порядке их процентного (весового) содержания в земной коре на группы по декадам*, то получится такая картина (табл. 2).
*(От греческого слова "дека"-десять)
| I | O-49,13Si-26,00 | IV | F-0,08Ra-0,05N-0,04Sr-0,035Cr-0,03Zr-0,025V-0,02Ni-0,02Zn-0,02B-0,01Cu-0,01 | VII | Se-8.10-5Sb-5.10-5Nb-3,2.10-5Ta-2,4.10-5 Pt-2.10-5Bi-1.10-5Ag-1.10-5In-1.10-5 | XII | Ra-1.10-10 |
| II | Al-7,45Fe-4,20Ca-3,25Na-2,40K-2,35Mg-2,35H-1,00 | V | Sn-0,008W-0,007Li-0,005Be-0,003Co-0,002Pb-0,0016Mo-0,001Cs-0,001Br-0,001Th-0,001 | VIII | He-1.10-6Te-1.10-6 | ||
| III | Ti-0,61C-0,35Cl-0,20P-0,12S-0,10Mn-0,10 | VI | Cd-5.10-4As-5.10-4U-4.10-4Ar-4.10-4Hg-1.10-4J-1.10-4Ga-1.10-4 | IX | Au-1.10-7Re-1.10-7 |
Из табл. 2 видно, что подавляющая масса минералов земной коры должна представлять соединения элементов первых двух декад, на долю которых в весовом выражении приходится 98,13%. В самом деле, в земной коре чрезвычайно широко распространены кислородные соединения кремния, алюминия, железа, а также щелочноземельных и щелочных металлов - кальция, магния, натрия и калия. К их числу относятся главным образом окислы и кислородные соли (силикаты, алюмосиликаты и др.), входящие в состав различных горных пород, слагающих земную кору.
Кларки металлов, играющих большую роль в промышленности, в подавляющем большинстве выражаются ничтожными величинами и попадают в последние столбцы элементов, разбитых на декады по степени распространения (табл. 3).
| Декады | II | III | IV | V | VI | VII | VIII | IX-XII |
|---|---|---|---|---|---|---|---|---|
| Металлы | Al,Fe,Mg | Mn | Cr,V,Ni,Zn,Cu | Sn,W,Be,Co,Pb,Mo | Cd,As,U,Hg,Ga | Sb,Nb,Ta,Pt,Bi,Ag,Ti,In | Os,Ru,Rh,Pd,Ir | Au,Re,Ra |
Некоторые особенности распределения тяжелых металлов в земной коре. Многие из указанных редких в земной коре элементов под влиянием совершающихся в природе геохимических п ссов нередко образуют исключительно богатые скопленирального вещества, носящие названия рудных месторождений. Если бы не существовало процессов, приводящих к образованию таких месторождений, которые имело бы смысл разрабатывать с целью извлечения ценных для промышленности металлов, то можно с уверенностью сказать, что не было бы и столь мощного развития техники и культуры, какое наблюдается в настоящее время. Тогда бы многие металлы, извлеченные из пород в лабораторных условиях, относились к исключительно дорогим металлам. Весьма характерно, что кларки таких металлов, как ванадий, цезий, галлий и др., во много раз выше кларков ртути, висмута, серебра, золота и др. Но, несмотря на их весьма ценные свойства, они в человеческом быту не распространены, так как их месторождения с промышленными концентрациями в природе крайне редки.
Природные соединения тяжелых металлов представляют собой в основном сравнительно простые соединения. Часть этих элементов (Fe, Mn, Sn, Cr, W, Nb, Та, Th, U) преимущественно распространена в виде кислородных соединений, но зато многие другие элементы (Fe, Ni, Со, Zn, Cu, Pb. Hg, Mo, Bi, As, Sb, Ag и др.) встречаются главным образом в виде скоплений сернистых, мышьяковистых и сурьмянистых соединений.
В. М. Гольдшмидт указывает, что распространенность элементов в земной коре по мере увеличения их порядковых чисел уменьшается (рис. 4). Это происходит большей частью по правилу: распространенность обратно пропорциональна седьмой-восьмой степеням порядкового числа. Однако бросаются в глаза отклонения для трех элементов: лития, бериллия и бора (рис. 4), имеющих низкие порядковые числа - 3,4 и 5. Для некоторых элементов наблюдаются отклонения в сторону увеличения (железо с порядковым номером 26).
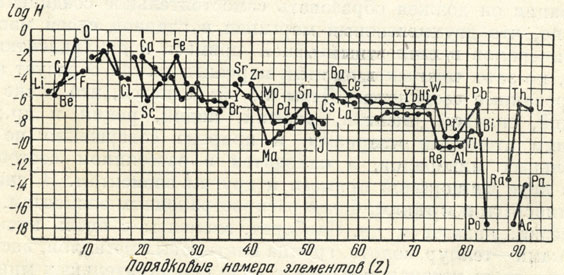
Рис. 4. Распространенность элементов в верхней части литосферы. На диаграмме даны логарифмы атомных концентраций (H) как функции порядкового номера (Z), причем кислород принят за единицу
Если сравнить распространенность химических элементов в земной коре в атомных кларках с числами минералов, в которые они входят, то, как указал П. П. Пилипенко, между ними, за небольшим исключением, устанавливается некоторая прямая (симбатная) зависимость. Это имеет место преимущественно для элементов, обладающих малыми атомными весами:*
*(В число минералов не включены лишь разновидности, в которые данный элемент входит в виде изоморфной примеси)
| Элемент | Атомный кларк | Число минералов |
|---|---|---|
| O | 53,39 | 1221 |
| H | 17,25 | 798 |
| Si | 16,11 | 377 |
| Al | 4,80 | 268 |
| Na | 1,82 | 100 |
| Mg | 1,72 | 105 |
| Ca | 1,41 | 194 |
| Fe | 1,31 | 170 |
| K | 1,05 | 43 |
| C | 0,51 | 194 |
| Ti | 0,22 | 30 |
| Cl | 0,10 | 67 |
| F | 0,07 | 50 |
Для многих тяжелых металлов подобная зависимость не устанавливается. Так, теллур, атомный кларк которого в земной коре примерно в 100 раз меньше, чем кларк селена, в природных условиях образует около 40 самостоятельных минералов, в то время как для селена их известно всего 28, и то главным образом в ассоциации с серой. Для цинка, с атомным кларком, в 50 раз большим по сравнению с кларком свинца, мы имеем 26 минералов, тогда как для свинца - около 130, и т. д.
Указанные различия несомненно вызываются химическими свойствами самих элементов, обусловленными строением их ионов и определяемыми положением этих элементов в периодической системе Менделеева. Для элементов с одинаковыми свойствами, аналогичными строением и размерами ионов, но с различными концентрациями в данном растворе или расплаве, естественно ожидать, что при кристаллизации элементы с меньшей концентрацией будут входить в кристаллические решетки, образуемые господствующими элементами, как бы растворяясь в них. Если же данный элемент в окружающей среде не находит аналогичных себе по размерам и строению ионов других элементов, то, в каком бы количестве он ни присутствовал в растворе, при кристаллизации он должен образовать самостоятельное соединение. Весьма показательно, что двухвалентный марганец в главной своей массе входит в состав минералов в виде изоморфной примеси к двухвалентным железу и кальцию, но зато четырехвалентный марганец всегда образует явно индивидуализированные соединения. Этим же объясняется, что такие элементы, как рубидий, скандий, галлий, гафний, индий, рений и др., обладающие низкими атомными кларками, в природе совершенно не образуют самостоятельных минералов, а находятся в рассеянном состоянии, присутствуя в виде изоморфной примеси к другим элементам. В значительной мере это относится и к таким, более распространенным элементам, как селен, ванадий, цезий, кадмий и др. Наоборот, элементы с очень низкими атомными кларками-теллур, золото, группа платиновых металлов, висмут и др. - сравнительно часто устанавливаются в виде самостоятельных минералов.
Важно указать, что общее число природных химических соединений несравненно меньше, чем их можно получить искусственным путем. Число одних только неорганических соединений, получаемых в лабораторных условиях, выражается многими сотнями тысяч. В природе же известно всего лишь около 1700 минералов, включая и их разновидности. Это ни в коем случае нельзя объяснять слабой изученностью состава земной коры. За последние десятилетия число ежегодно открываемых новых минералов перестало превышать 10-20, несмотря на совершенствование методик и тщательность проводимых исследований. Возможности же синтеза искусственных соединений все более и более расширяются. Установлено, например, что элементы группы платины способны дать огромное количество самых разнообразных и сложных химических соединений, а в природных условиях известно буквально не больше трех десятков минералов, и то преимущественно в виде самородных металлов.
Таким образом, природная химия, или геохимия, особенно глубинных частей земной коры, по сравнению с лабораторной химией значительно проще по тем конечным продуктам, которые мы изучаем в виде минералов. Многие природные химические реакции протекают при высоких температурах и давлениях, нередко в твердых средах и в течение весьма длительного времени. Минералогия самой поверхностной части литосферы, особенно зоны выветривания, где господствуют низкие температуры и давления, гораздо сложнее. Но все же концентрации многих химических компонентов в поверхностных растворах столь низки, что общее количество образующихся здесь соединений значительно уступает тому, что может быть получено в лаборатории.
|
ПОИСК:
|
© GEOMAN.RU, 2001-2021
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'
При использовании материалов проекта обязательна установка активной ссылки:
http://geoman.ru/ 'Физическая география'